
【题目】不能正确表示下列变化的离子方程式是
A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
C.碳酸氢钠溶液和过量的澄清石灰水混合:2HCO3-+ Ca2+ + 2OH-= CaCO3↓+ CO32- + 2H2O
D.醋酸钠水解:CH3COO+H2O![]() CH3COOH+OH
CH3COOH+OH
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 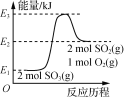 由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
B.  表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
C. 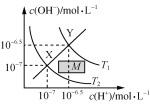 温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
D. 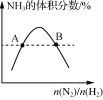 表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
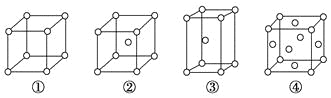
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色溶液,且在溶液中四种离子的物质的量浓度均为1 mol·L-1。下列四个离子组能达到要求的是( )
A.Na+、K+、![]() 、Cl-B.Cu2+、K+、
、Cl-B.Cu2+、K+、![]() 、
、![]()
C.H+、K+、![]() 、Cl-D.Mg2+、Na+、Cl-、
、Cl-D.Mg2+、Na+、Cl-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
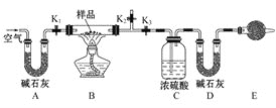
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是元素周期表的一部分, 回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | i |
(1)d、e、f对应简单离子的半径由大到小的顺序为_______(用具体微粒符号表示)。
(2)元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为_____;写出a与c形成的一种含18电子且既含极性键又含非极性键的化合物的分子式_________。
(3)以元素a的单质为燃料,以f的最高价氧化物对应的水化物为电解质溶液,请写出该燃料电池的负极反应方程式_________。
Ⅱ. (1)根据下列信息判断氢气燃烧生成水时的热量变化:

①H2(g)与O2(g)反应生成1molH2O(g)时放出的热量为________kJ;
②图中甲、乙、丙中物质所具有的总能量由大到小顺序为:________;
(2)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为__________,一段时间后,负极增重48克,转移电子_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题:

(1)B的作用:_________;C中热水的作用:__________;
(2)M处发生反应的总反应方程式为__________;
(3)从M管中可观察到的现象:______,从中可认识到该实验过程中催化剂______(填“参加”或“不参加”)化学反应。
(4)实验进行一段时间后,若撤掉酒精灯,反应仍能继续进行,则说明________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3 作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。以下说法正确的是( )

A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B.该电池可以用水溶液做电解质溶液
C.放电时,Fe作电池的负极,Fe2O3作电池的正极
D.充电时,电池被磁铁吸引
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:
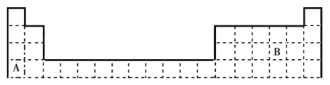
(1)B在周期表中的位置是__;写出A、B的单质之间发生反应的化学方程式:__。
(2)写出表中位于长周期的卤族元素的名称:__;属于短周期的碱金属元素的元素符号为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com