
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.11.2 L CO2所含分子数为0.5 NA
B.1 L 0.1 mol·L-1的Na2S溶液中离子数为0.3 NA
C.0.5 mol FeBr2与足量氯气反应转移的电子数为NA
D.14.2 g Na2SO4固体中阴离子所带电荷数为0.2 NA
科目:高中化学 来源: 题型:
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径: Rb>I B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
⑶若XM3最初水解产物是XH3和HMO,则X、M元素的电负性大小顺序是:X_____M((填>、<、或=);若已知磷与M元素电负性关系是:P<M,则PM3水解的化学反应方程式是 。
(4)已知QM3的熔点为190℃(2.02×105Pa),但它在180℃即开始升华,则QM3是_________(填“离子化合物”或“共价化合物”),如何通过实验判别__________________。在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g/L,则QM3的结构式为_________。
(5)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
(1)配平以下离子方程式,并在□中填上所需的微粒。
____H++____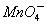 +_____H2C2O4→_____CO2↑+____Mn2++____□
+_____H2C2O4→_____CO2↑+____Mn2++____□
(2)该反应中的还原剂是_______________________。
(3)反应转移了0.4mol电 子,则消耗KMnO4的物质的量为_________mol。
子,则消耗KMnO4的物质的量为_________mol。
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是___________________。
②溶解沉淀时_____________(能或不能)用稀盐酸,原因是_____________。
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙_______g
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲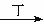 乙
乙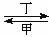 丙。下列有关物质的推断不正确的是
丙。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是氯气 D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活密切相关。下列叙述错误的是
A.光导纤维和陶瓷都是硅酸盐产品
B.晶体硅可用于制造芯片
C.钢铁厂用热还原法冶炼铁
D.焙制糕点的发酵粉主要成分之一是碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的方程式错误的是
A.测得0.1 mol·L-1氨水的pH为11:NH3·H2O NH4+ +OH-
NH4+ +OH-
B.将Na块投入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 Cu2++2Cl-
Cu2++2Cl-
D.将1 mol·L-1FeCl3溶液滴入沸水中,得到透明红褐色液体:
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
4种短周期元素相对位置如右表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:
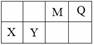
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) = 1.3×10-3 mol·L-1。则HR  H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:
v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~6 min的平均反应速率:
v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6 min时,c(H2O2)=0.30 mol/L
D.反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________。
(2)由总 压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________。
压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反 应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
| 反应时间t/h |
| 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔( Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________
Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________
mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com