
| 10-13 |
| 10-11 |
| c(酸)V(酸)-c(碱)V(碱) |
| V(酸)+V(碱) |
| 10-13 |
| 10-11 |
| 0.1b-0.01a |
| a+b |
| 0.05×2 |
| 2+9 |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
| 0.01mol/L KIO3溶液的体积/mL | Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色所需的时间 | |
| 实验1 | 5 | 5 | V1 | 0 | a |
| 实验2 | 5 | 5 | 40 | 25 | b |
| 实验3 | 5 | V2 | 35 | 25 | c |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
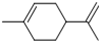 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A、分子式C10H14 |
| B、常温下为液态,难溶于水 |
| C、它属于芳香烃 |
| D、1mol该物质与1molHCl加成所得产物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出)H:1 O:16 C:12
实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出)H:1 O:16 C:12查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12个 | B、8个 | C、4个 | D、6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [NO][SO3] |
| [NO2][SO2] |
| A、该反应的焓变为正值 |
| B、恒温下减小压强,反应体系的颜色加深 |
| C、升高温度,逆反应速率减小 |
| D、该反应化学方程式为NO2+SO2?NO+SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com