
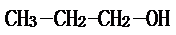 ��2-������
��2-������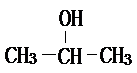 ��
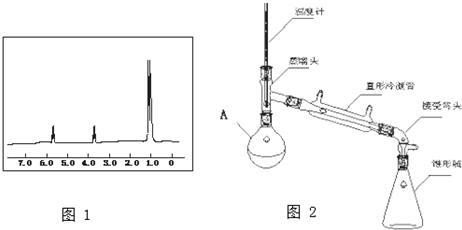
��
���� ��1�����ݸ��л���ĺ˴Ź������еķ�����ȿ���ȷ�����л�������к��еIJ�ͬ������ԭ�ӵ�����������ȷ���л���Ľṹ��ʽ��1-������2-����������ȥ��Ӧ�����ɱ�ϩ����������ˮ��Ҳ�������л��ܼ�����Ϊͬ���칹�壬�����Է������Ӽ���ˮ���ѣ�
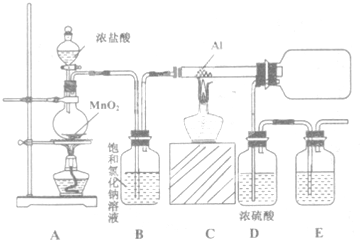
��2������װ��ͼ��֪Aװ�����ƣ�
��3��1-�������廯�ƿ���Ũ����������¼��ȿ�����1-����飻
��4��1-�������廯�Ʒ�ӦҪ��Ũ��������������98.3%��Ũ������ǿ���������ɣ������Ҵ���Ӧ���ɶ�����̼�Ͷ������ݴ��жϣ�
��5��ʯ���ѽ�ɵ���ϩ�ͱ�ϩ��С���Ӳ���������
��� �⣺��1�����ݸ��л���ĺ˴Ź������еķ�����ȷֱ�Ϊ1��1��6��֪�����л�������к��еIJ�ͬλ����ԭ����3�֣��ֱ�����ԭ����֮��Ϊ1��1��6��1-������CH3-CH2-CH2-OH}�в�ͬλ�õ���ԭ�������֣�����Ŀ֮��Ϊ1��3��4��2-���� �в�ͬλ�õ���ԭ�������֣�����ԭ����Ŀ֮��Ϊ1��1��6��������������������Ϊ��2-������1-������2-����������ȥ��Ӧ�����ɱ�ϩ����������ˮ��Ҳ�������л��ܼ�����Ϊͬ���칹�壬�����Է������Ӽ���ˮ���ѣ���ѡABD��
�в�ͬλ�õ���ԭ�������֣�����ԭ����Ŀ֮��Ϊ1��1��6��������������������Ϊ��2-������1-������2-����������ȥ��Ӧ�����ɱ�ϩ����������ˮ��Ҳ�������л��ܼ�����Ϊͬ���칹�壬�����Է������Ӽ���ˮ���ѣ���ѡABD��
�ʴ�Ϊ��2-������ABD��
��2������װ��ͼ��֪Aװ������Ϊ������ƿ��
�ʴ�Ϊ��������ƿ��
��3��1-�������廯�ƿ���Ũ����������¼��ȿ�����1-����飬��Ӧ�Ļ�ѧ����ʽΪCH3CH2CH2OH+HBr$��_{��}^{ŨH_{2}SO_{4}}$CH3CH2CH2Br+H2O��
�ʴ�Ϊ��CH3CH2CH2OH+HBr$��_{��}^{ŨH_{2}SO_{4}}$CH3CH2CH2Br+H2O��
��4��1-�������廯�Ʒ�ӦҪ��Ũ��������������98.3%��Ũ������ǿ���������ɣ������Ҵ���Ӧ���ɶ�����̼�Ͷ����������Ա�ʵ�����������Ũ�������70%��
��ѡC��
��5��ʯ���ѽ�ɵ���ϩ�ͱ�ϩ��С���Ӳ������������Ա�ϩ��ʯ���ѽ�IJ��
�ʴ�Ϊ���ѽ⣮
���� ���⿼�����л������ʽ��ȷ��֪ʶ����Ŀ�ѶȽ�С����ȷ�˴Ź������еķ�����ȿ���ȷ�����л�������к��еIJ�ͬ������ԭ�ӵ������ǽ���ؼ�������ͨ���������ѵ���ȡ�������˶���Ϣ�Ĵ����������Ի���ʵ�����������������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ù��˵ķ�������CaCO3��CaCl2��Һ�Ļ���� | |
| B�� | �ýᾧ���ᴿNaCl��KNO3������е�KNO3 | |
| C�� | ���������Ҵ���ˮ�Ļ���� | |
| D�� | �ü��ȷ��������Ȼ�淋Ļ�����ʾ�������������Ȼ�������ֽ⣮��ȴ�����Ƕ����������ɹ��壩 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molH2����Ϊ2g | B�� | H2O��Ħ������Ϊ18g | ||
| C�� | �����44g CO2�����Ϊ22.4L | D�� | 9.8g H2SO4��1mol��H2SO4���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
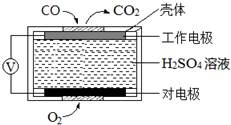 ̼��������������������Ĵ�������������������о����ȵ����⣮
̼��������������������Ĵ�������������������о����ȵ����⣮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 5min��ƽ����Ӧ����vA=0.15mol•L-1•min-1 | |
| B�� | ��ͬʱ��ԭƽ����ϵ����һ���¶Ⱥ�����һ��ѹǿʱ����ƽ���C�����ʵ�������Ϊ60%����÷�Ӧ������ӦΪ���ȷ�Ӧ | |
| C�� | ���������������䣬����ʼʱ�������м���0.5molA��0.5molB��1.5molC����Ӧ�����淴Ӧ������� | |
| D�� | t�棬��2L�ܱա����������м�������ʵ�����A��B����Ӧ�ﵽƽ��״̬ʱ��C�����ʵ���������Ϊ60%�������A�����ʵ���Ϊ1.6mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
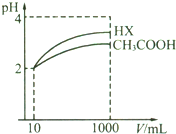 25��ʱ������ƽ�ⳣ����
25��ʱ������ƽ�ⳣ����| ��ѧ�� | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ�� | 1.8��10-5 | K14.3��10-7 K25.6��10-11 | 3.0��10-8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com