
| A. | 1mol N2(g)和 3mol H2(g)具有的能量之和低于 2 mol NH3(g)具有的能量 | |
| B. | 将 1mol N2(g)和 3mol H2(g)置于一密闭容器中充分反应后放出 Q kJ 的热量 | |
| C. | 升高温度,平衡向逆反应方向移动,上述热化学方程式中的 Q 值减小 | |
| D. | 将一定量 N2、H2置于某密闭容器中充分反应放热 Q kJ,则此过程中有 3mol H2被氧化 |
分析 A.该反应为放热反应,反应物总能量高;
B.合成氨反应为可逆反应,不能完全转化;
C.为放热反应,升高温度逆向移动,但反应的△H不变;
D.物质的量与反应中的能量变化成正比.
解答 解:A.该反应为放热反应,1mol N2(g)和 3mol H2(g)具有的能量之和高于 2 mol NH3(g)具有的能量,故A错误;
B.合成氨反应为可逆反应,不能完全转化,则将 1mol N2(g)和 3mol H2(g)置于一密闭容器中充分反应后放出热量小于 Q kJ,故B错误;
C.为放热反应,升高温度逆向移动,但反应的△H不变,即上述热化学方程式中的 Q 值不变,故C错误;
D.物质的量与反应中的能量变化成正比,则一定量 N2、H2置于某密闭容器中充分反应放热 Q kJ,则此过程中有 3mol H2被氧化,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应的特点、平衡移动、反应中能量变化为解答的关键,侧重分析与应用能力的考查,注意物质的量与能量的关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物的光合作用使得太阳能转化为化学能 | |
| B. | 人类使用照明设备是将电能转化为光能 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 燃料燃烧时只是将化学能转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+$\frac{3}{2}$O2(g)=CO(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 中和热测定实验中的终止温度就是实验过程中混合液的最高温度 | |
| C. | 为了减少大气中的雾霾,天然气日渐成为一种备受关注的可再生的清洁能源 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ①②⑤⑥ | C. | ②③④⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
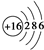 .
. ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com