
(12分)原子序数小于36的x、Y、z、w四种元素,元素x的原子核外最外层电子数是内层电子数的2倍,元素Y与x同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,z是x的同族相邻元素;w是第Ⅷ族元素中原子序数最小的元素。用元素符号回答下列问题:
(1)X、Y、Z的电负性由小到大的顺序是 。
(2) N3一与x、Y形成的一种化合物互为等电子体,则N3一的空间构型为 、电子式为 。
(3)同为原子晶体的XY2与ZY2中硬度小的是 。
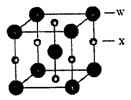
(4)X和W所形成的某种晶体结构如图7所示,写出:
①基态W2+离子的价电子排布式 ;
②该晶体的化学式 。
(1)Si<C<O (2)直线型 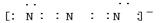
(3)SiO2 (4)①3d6 ② FeC
【解析】根据元素的结构及有关性质可知,x、Y、z、w四种元素分别是C、O、Si、Fe。
(1)非金属性越强,电负性越大,所以X、Y、Z的电负性由小到大的顺序是Si<C<O。
(2)价电子数和原子数分别都相等的是等电子体,所以与N3一互为等电子体的是CO2,因此N3一的空间构型为直线型,电子式为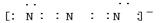 。
。
(3)形成原子晶体的原子半径越小,共价键越强,硬度越大。碳原子半径小于硅原子半径,所以二氧化硅的硬度小。
(4)①根据构造原理可知,基态W2+离子的价电子排布式3d6。
②根据晶胞结构可知,含有铁原子是1+8×1/8=2,碳原子是2×1/2+4×1/4=2,所以化学式是FeC。


科目:高中化学 来源: 题型:
(12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是_______
(2)X与W组成的化合物中存在_______键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为____________________________________________________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A。
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式_________________________________________
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:
____________________________________________________ 。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
B.B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为 ______________ 。
② 已知1 mol·L—1 100mL B的溶液能与1 mol·L—1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省嘉兴一中高三10月月考化学试卷(带解析) 题型:填空题
(共12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的核外电子排布为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式: ;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为 。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式 。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三10月月考化学试卷(解析版) 题型:填空题
(共12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的核外电子排布为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式: ;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为 。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式 。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2013届江西省高一下学期期中考试化学试卷 题型:填空题
(12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是_______
(2)X与W组成的化合物中存在_______键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为____________________________________________________ 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A。
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式_________________________________________
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:
____________________________________________________ 。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
B.B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为 ______________ 。
② 已知1 mol·L—1 100mL B的溶液能与1 mol·L—1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com