
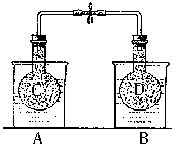
 NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。
NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。 N2O4(g)
N2O4(g) 2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。
2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。 科目:高中化学 来源: 题型:
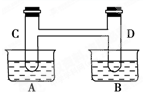 如右图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通.其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2?N2O4△H=-57kJ/mol;当向A中加入50g NH4NO3晶体使之溶解;向B中加入2g苛性钠时:
如右图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通.其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2?N2O4△H=-57kJ/mol;当向A中加入50g NH4NO3晶体使之溶解;向B中加入2g苛性钠时:查看答案和解析>>
科目:高中化学 来源: 题型:
 江苏拥有较长的海岸线,浩瀚的海洋是一个巨大的物质宝库。目前世界各国都在研究如何充分利用海洋资源。
江苏拥有较长的海岸线,浩瀚的海洋是一个巨大的物质宝库。目前世界各国都在研究如何充分利用海洋资源。
⑴如右图所示,在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,该方法称为电渗析法。
①图中膜a应选用 ▲ 膜。
②电渗析法还可用来处理电镀废液,写出用该方法处理含硝酸银废液时所发生反应的化学方程式 ▲ 。
⑵海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢—水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同的温度下发生的两个不同反应得到较高浓度的HDO。
 ①从物质的微粒构成看,H2O、HDO的不同点是 ▲ 。
①从物质的微粒构成看,H2O、HDO的不同点是 ▲ 。
②右图为“硫化氢—水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线。写出100℃时所发生反应的化学方程式 ▲ ;工业上富集HDO的生产过程中,可以循环利用的一种物质是 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省江都区丁沟中学高二下学期期中考试化学试卷(带解析) 题型:填空题
已知水在25℃和95℃时,其电离平衡曲线如右图所示: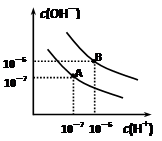
⑴则25 时水的电离平衡曲线应为 (填“A”或“B”)。
时水的电离平衡曲线应为 (填“A”或“B”)。
⑵25 时,将
时,将 =8的NaOH溶液与
=8的NaOH溶液与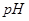 =5的
=5的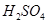 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的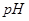 =7,则NaOH溶液与
=7,则NaOH溶液与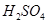 溶液的体积比为 。
溶液的体积比为 。
⑶95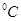 时,0.1 mol/L的NaOH溶液的pH值是 。
时,0.1 mol/L的NaOH溶液的pH值是 。
⑷95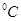 时,若100体积
时,若100体积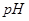 1=
1=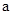 的某强酸溶液与1体积
的某强酸溶液与1体积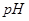 2=b的某强碱溶液混合后溶液呈中性,则混合前,
2=b的某强碱溶液混合后溶液呈中性,则混合前,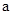 与b之间应满足的关系是
与b之间应满足的关系是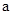 = (用含b的代数式表示),a+b_______14(填“<”、“=”或“>”)。
= (用含b的代数式表示),a+b_______14(填“<”、“=”或“>”)。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省高二下学期期中考试化学试卷(解析版) 题型:填空题
已知水在25 ℃和95 ℃时,其电离平衡曲线如右图所示:
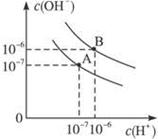
⑴则25 ℃时水的电离平衡曲线应为 ___ (填“A”或“B”),请说明理由 ________________ 。
⑵95 ℃时PH=2的NaOH溶液中由水电离的c(H+) ______。
⑶25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 _________ 。
⑷25 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 _____ 。
⑸曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析原因: 。
⑹95 ℃时,某氨水与氯化铵的混合溶液的PH=7,则c(NH4+)______c(Cl-)(填“>”、“<”、或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com