
下列描述正确的是( )
|
| A. | 摩尔是国际单位制中的一个基本物理量 |
|
| B. | 有单质参加或有单质生成的化学反应都属于氧化还原反应 |
|
| C. | 当光束分别通过氢氧化铁胶体、氯化铁溶液时,都可以从侧面看见光亮的通路 |
|
| D. | 分液时,先将分液漏斗中下层液体放出,然后再将上层液体从上口倒出 |
考点:
分液和萃取;胶体的重要性质;氧化还原反应.
专题:
化学实验基本操作.
分析:
A、摩尔是单位不是物理量.
B、有单质参加或有单质生成的化学反应不一定属于氧化还原反应.
C、胶体能产生丁达尔效应,溶液不能产生丁达尔效应.
D、分液时,上层液体从上口倒出,中下层液体从下口倒出.
解答:
解:A、摩尔是单位不是物理量,物质的量是国际单位制中的一个基本物理量,物质的量的单位是摩尔,故A错误.
B、有单质参加或有单质生成的化学反应不一定属于氧化还原反应,如3O2=2O3,因为没有该反应没有电子的转移,所以不是氧化还原反应,故B错误.
C、胶体能产生丁达尔效应,溶液不能产生丁达尔效应,当光束通过氢氧化铁胶体时能从侧面看见光亮的通路,而当光束通过氯化铁溶液时,不能从侧面看见光亮的通路,故C错误.
D、分液时,上层液体从上口倒出,中下层液体从下口倒出,故D正确.
故选D.
点评:
本题考查了实验操作、物质的性质等知识点,难度不大,易错选项是B,注意同素异形体的相互转化虽然有单质参加反应但不是氧化还原反应,有电子转移的化学反应才是氧化还原反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②K (Ni(OH)
(Ni(OH) ): 5.0×10-16 , K
): 5.0×10-16 , K (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
|
| A. | H2O的电子式: |
|
| B. | 质量数为14的碳原子: |
|
| C. | CO2的比例模型: |
|
| D. | Cl﹣的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一体积不变的密闭容器中发生如下化学反应:2A(g)⇌B(g)+2C(g).当物质A的起始浓度为1.0mol•L﹣1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如各图所示:
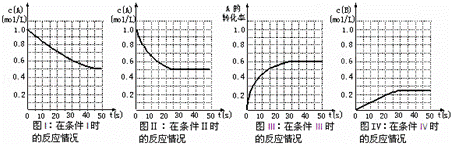
下列有关说法中正确的是( )
|
| A. | 条件Ⅰ、条件Ⅱ时的反应温度不同,压强相同 |
|
| B. | 条件Ⅰ时可能未使用催化剂,条件Ⅱ时可能使用了催化剂 |
|
| C. | 条件Ⅲ时的平衡混合物中,物质C的浓度等于0.6mol•L﹣1 |
|
| D. | 条件Ⅳ和条件Ⅱ相比较,条件Ⅳ时可能增大了反应体系的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol·L﹣1、0.001mol·L﹣1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol·L﹣1)的用量均为2mL.
(1)配平化学方程式:
KMnO4+ H2C2O4+ H2SO4→ K2SO4+ MnSO4+ CO2+ H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol·L﹣1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和 ④ 探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ | 0 |
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是
若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液 的浓度/mol·L﹣1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
计算用0.001 mol·L﹣1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率 (忽略混合前后溶液体积的变化).
(5)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行? .若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中一定正确的是( )
A.Na2O2固体中阳离子与阴离子的个数比为1∶1
B.从试剂瓶中取出并切下的未使用的钠可放回原试剂瓶中
C.将Na投入饱和Na2CO3溶液中,会导致溶液质量增加
D.金属Na失火,可用CO2灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
|
| A. | 互为同分异构体的分子结构几乎完全相同 |
|
| B. | 丙氨酸CH3﹣CH(NH2)﹣COOH存在手性异构体 |
|
| C. | 标准状况下,相同体积的NH3、CH4、HF含有相同的电子数 |
|
| D. | 等体积的CO和N2混合后所得的混合气体的平均摩尔质量为28 g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com