
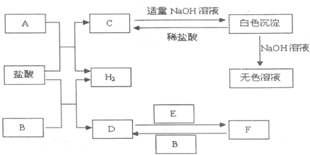
 下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.
下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.

科目:高中化学 来源: 题型:
| A、无法确定 |
| B、0.08 mol?L-1?min-1 |
| C、0.32 mol?L-1?min-1 |
| D、0.06 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 I、将锌片浸在硫酸铜中,用一根细铜棒抵住锌片的中部,发现铜棒变粗了,一段时间后,被铜棒抵住的部位出现了一个洞口.请你解释这两个现象:
I、将锌片浸在硫酸铜中,用一根细铜棒抵住锌片的中部,发现铜棒变粗了,一段时间后,被铜棒抵住的部位出现了一个洞口.请你解释这两个现象:查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作及现象 | 实验结论 | |
| A | 向2mL 0.1mol?L-1 CH3COOH溶液中滴加等浓度的NaHCO3溶液,有气泡产生 | 酸性: CH3COOH>H2CO3 |
| B | 向2mL 0.1mol?L-1 NaOH溶液中滴加3滴0.1mol?L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol?L-1 FeCl3溶液,出现红褐色沉淀 | 溶度积: Mg(OH)2>Fe(OH)3 |
| C | 在少量无水乙醇中加入金属Na,生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| D | 用3mL稀H2SO4溶液与足量Zn反应,当气泡稀少时,加入1mL浓H2SO4,又迅速产生较多气泡 | H2SO4浓度增大,反应速率加快 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
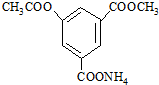 某有机物的结构简式如图所示,该物质1mol与足量NaOH溶液充分反应,消耗NaOH物质的量为( )
某有机物的结构简式如图所示,该物质1mol与足量NaOH溶液充分反应,消耗NaOH物质的量为( )| A、5mol | B、4mol |
| C、3mol | D、2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com