

| A、步骤3的操作名称是过滤 |
| B、步骤1所需玻璃仪器是烧杯和玻璃棒 |
| C、试剂A是BaCl2溶液 |
| D、加入试剂A 的目的是除去CO32-并避免对Cl-或OH-的检验的干扰 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
239 94 |
| A、原子序数是239 |
| B、质量数是94 |
| C、中子数是239 |
| D、质子数是94 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏法 | B、水洗分液法 |
| C、升华法 | D、有机溶剂萃取法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
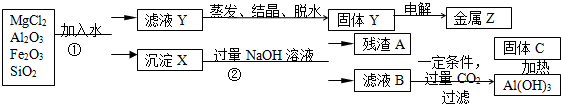
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后:查看答案和解析>>
科目:高中化学 来源: 题型:
 金属冶炼和处理常涉及许多反应.
金属冶炼和处理常涉及许多反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com