
【题目】下列有关化学用语表示正确的是 ( )
A. 过氧化氢的电子式:![]()
B. HClO的结构式为:H—Cl—O
C. 氟离子的结构示意图:![]()
D. MgO的形成过程可以表示为:![]()
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】对某滴有酚酞的饱和NaCl溶液在如图装置中进行电解,回答下列问题:
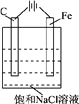
(1)C极现象为___________,Fe极(含其周围的溶液)现象为:_____________________。
(2)若电解一段时间以后,将电源反接,C极电极反应式为:___________________,溶液中可以观察到的现象是:_____________________________________________。再向该溶液中通入O2,又会观察到的现象是:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取1.43g Na2CO3·10H2O溶于水配成100mL溶液,求:Na2CO3物质的量浓度________,取出20mL该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004mol/L,求加入蒸馏水的体积_________(设稀释时,对溶液体积的影响忽略不计)
(2)用98%的浓H2SO4(ρ=1.84g/cm3)配制500mL0.5mol/L的稀H2SO4,所需浓H2SO4的体积为__________,如果实验室有10mL、20mL、50mL量筒,应选用___________mL量筒,定容时俯视刻度线测定结果会____________________(填偏高、偏低、无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬(Cr)的本意是颜色,因为它的化合物或离子都有美丽的颜色。下表是几种常见含铬的离子水溶液的颜色:
离子 | Cr2O72- | Cr(OH)4 | Cr3+ | CrO42- | Cr2+ |
颜色 | 橙色 | 绿色 | 蓝紫色 | 黄色 | 蓝色 |
(1)铬铁矿的主要成分是Fe(CrO2)2,该物质中三种元素的化合价均为整数,则Cr的化合价是_____________。
(2)向Na2CrO4溶液中加入浓盐酸,溶液会变为蓝紫色并有黄绿色气体产生,则氧化剂和还原剂的物质的量之比为_____________。
(3)向Na2Cr2O7溶液中加入浓NaOH溶液,会变成黄色,请解释原因(用离子方程式和必要的文字说明)_____________________________________________。
(4)工业上以铬铁矿[主要成分为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料,生产重铬酸钠晶体(Na2Cr2O7·2H2O)。主要工艺流程如下:
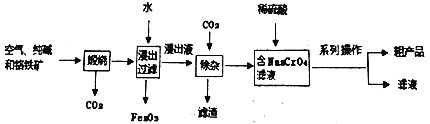
①滤渣的成分是_____________(写化学式)
②写出煅烧过程中,所发生的非氧化还原反应的化学方程式(任写一个)______________________。
③煅烧过程中,所发生的氧化还原反应如下:(其中浸出液显黄色),请完成下面化学方程式并配平。
□Fe(CrO2)2+□Na2CO3+□O2=□_________+□Fe2O3+□CO2
④工业上在重铬酸钠溶液中加入适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据各地报纸报导,在一些建筑工地的食堂里,常发生将工业用盐当作食盐用,引起工人食物中毒的现象,该工业用盐对人有致癌作用。这种盐的化学式是:
A. MgCl2 B. NaCl C. NaNO2 D. NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国幅员辽阔,资源丰富,可为硫酸、玻璃、铁和铝等化工产品的生产提供原料。下列原料选择不正确的是
A. 以赤铁矿为原料冶炼铁 B. 以硫铁矿为原料生产硫酸
C. 以铝土矿为原料生产金属铝 D. 以冰晶石为原料生产普通玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0L的两个恒容密闭容器中加入足量的相同质量的固体B,再分别加入0.1molA和0.2molA,在不同温度下反应A(g)+B(s)![]() 2C(g)达到平衡,平衡时A的物质的量浓度c(A)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2C(g)达到平衡,平衡时A的物质的量浓度c(A)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
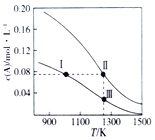
A. 反应A(g)+B(s)![]() 2C(g)△S>0、△H<0
2C(g)△S>0、△H<0
B. A的转化率:a(状态Ⅱ)>a(状态Ⅲ)
C. 体系中c(C)∶c(C,状态Ⅱ)>(C,状态Ⅲ)
D. 化学平衡常数:K(状态Ⅰ)=K(状态Ⅲ)>K(状态Ⅱ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)二氧化硫是一种污染性气体,工业上常利用Fe2+的催化作用,常温下使SO2转化为SO42-,其总反应为2SO2+O2+2H2O=2H2SO4。上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: _____________________________。
(2)ClO2是一种高效的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:

①氯化钠电解槽内的阳极产物为:__________。
②二氧化氯发生器所产生的气体中二氧化氯的体积分数为:__________。
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。写出该反应的离子方程式_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com