
分析 依据溶质浓度和溶液PH分析判断HA为弱酸,乙溶液中根据离子积常数和(OH-):c(H+)=1012 计算溶液中的氢氧根离子浓度分析判断BOH是强碱还是弱碱;依据强电解质、弱电解质写出电离方程式.
解答 解:甲为0.1mol/L的HA溶液,pH>1,说明酸未完全电离,即HA为弱酸,故其电离方程式为:HA?H++A-;乙溶液为0.1mol/L的BOH溶液,根据水的离子积可知溶液中c(H+)c(OH-)=10-14,而c(OH-):c(H+)=1012,可解得氢氧根离子浓度为:c(OH-)=10-13mol/L,即BOH是强碱,则电离方程式为:BOH=B++OH-;
故答案为:HA?H++A-;BOH=B++OH-.
点评 本题考查了弱电解质和强电解质的电离方程式的书写,应注意强电解质的电离用等号,弱电解质的电离用可逆号,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 二甲醚分子中既含有极性键又含有非极性键 | |
| B. | 二甲醚与乙醛是同分异构体 | |
| C. | 在二甲醚构成的燃料电池中,每消耗0.5mol二甲醚可以向外电路提供6 mol e- | |
| D. | 二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1455kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1 | B. | 0.05mol•L-1 | C. | 0.017mol•L-1 | D. | 0.50mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L盐酸 | B. | pH=11氨水 | ||
| C. | pH=4NaHSO3溶液 | D. | 0.01mol/L Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
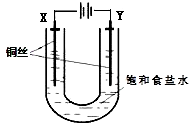 已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )| A. | Y极发生的电极反应2H2O+2e-═2OH-+H2↑ | |
| B. | 实验开始时,X极附近出现白色浑浊 | |
| C. | 一段时间后,U形管底部形成橙黄色沉淀 | |
| D. | 电解时,Cl-移向Y极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com