
分析 NaOH和HCl发生反应NaOH+HCl=NaCl+H2O,如二者恰好中和,应满足n(NaOH)=n(HCl),结合n=cV计算该题.
解答 解:n(NaOH)=0.1mol/L×0.025L=0.0025mol,与HCl发生NaOH+HCl=NaCl+H2O,如二者恰好中和,应满足n(NaOH)=n(HCl),
则V(HCl)=$\frac{0.0025mol}{0.2mol/L}$=0.0125L=12.500mL,
答:0.1mol•L-1NaOH25.00mL与0.2000mol•L-1HCl溶液12.500毫升才能恰好完全反应.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握反应的化学方程式以及相关计算公式的运用,难度不大.


科目:高中化学 来源: 题型:实验题
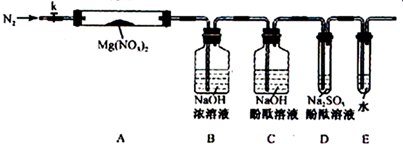
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 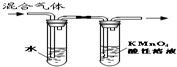 装置可用于检验溴乙烷消去反应的产物 | |
| B. | 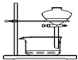 装置可用于放出碘的四氯化碳溶液 | |
| C. | 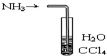 装置可用于吸收NH3防止倒吸 | |
| D. | 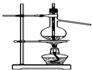 装置可用于实验室制备蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
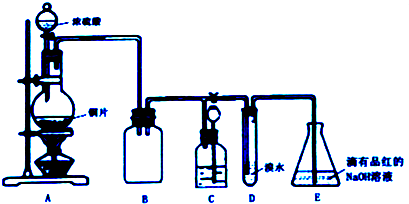
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | II | |
| ③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 | |
| B. | 工业用石灰石、纯碱和石英在高温下制得玻璃的原理与硅酸和碳酸的酸性强弱无关 | |
| C. | 以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3、BaSO4、Na2CO3 | B. | CuSO4、NaCl、NaCO3 | ||
| C. | NaCl、CuSO4、CaCO3 | D. | NaCl、KNO3、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
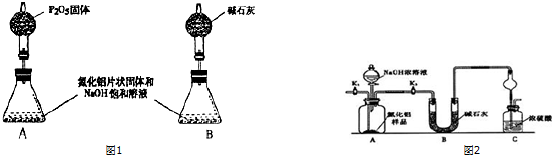
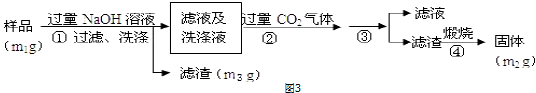
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com