
 CO2+H2���ﵽƽ��ʱ��
CO2+H2���ﵽƽ��ʱ��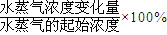 ��K=
��K=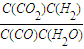 ��
�� CO2+H2��
CO2+H2�� =40%��
=40%�� CO2+H2��
CO2+H2�� =1
=1 CO2+H2��
CO2+H2��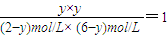
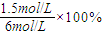 =25%��
=25%�� CO2+H2��
CO2+H2�� =1
=1

 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| T��K�� | 938 | 1100 |
| K | 0.68 | 0.40 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X | ||
| Y | Z |
| �¶�/�� | 500 | 700 | 850 | 1 000 |
| ƽ�ⳣ�� | 2.5 | 1.7 | 1.0 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ��̨�и�����ѧ����ĩͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪���淴ӦCO(g)��H2O(g)  CO2(g)��H2(g) ��H��0����Ӧ�ﵽƽ��״̬�������CO��ת���ʣ����Բ�ȡ�Ĵ�ʩΪ
CO2(g)��H2(g) ��H��0����Ӧ�ﵽƽ��״̬�������CO��ת���ʣ����Բ�ȡ�Ĵ�ʩΪ
A������ѹǿ B�������¶� C������CO��Ũ�� D�������CO2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com