
【题目】下列说法正确的是
A. HNO3的摩尔质量为63g
B. 常温、常压下,32克O2含有2NA个O
C. 标准状况下,1molH2O的体积约为22.4L
D. 1L1mol/LCH3COONa溶液中c(CH3COO—)=1mol/L
科目:高中化学 来源: 题型:
【题目】下列各物质的分类、名称(或俗名)、化学式都正确的是( )
A.金属氧化物、氧化铁、FeO
B.非金属氧化物、二氧化硫 、SO2
C.碱性氧化物、 过氧化钠 、 Na2O2
D.碱 、 纯碱 、 Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
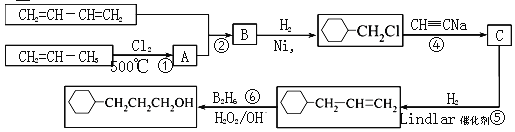
【题目】工业上以1,3-丁二烯,丙烯,乙炔等为原料合成![]() 流程图如下
流程图如下
已知:有机反应中有一种双烯加成反应,如:CH2=CH—CH=CH2+CH2=CH2→ 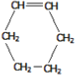 。
。
(1)反应①的反应类型是______________,B中含有的官能团的名称________________。
(2)写出反应②的化学方程式__________________________。
(3)写出C的结构简式_______________。
(4)写出![]() 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式__________。
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式__________。
(5)根据以上合成信息,以乙烯为原料合成1,6—己二醇,其他试剂任选,写出合成的流程图________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
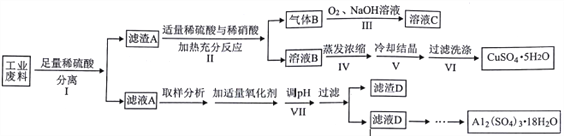
请回答:
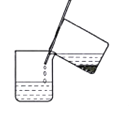
(1)步骤Ⅰ反应后分离操作可用下图所示方法,适用该方法分离的沉淀特点是___________________。
(2)写出步骤Ⅱ中发生反应的离子方程式___________________。写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式___________________。
(3)步骤Ⅳ蒸发浓缩的具体操作是___________________。
(4)下列有关实验说法正确的是___________________。
A. 步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入几粒晶种并加快溶液冷却速度的方法
B. 步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a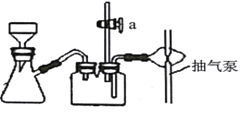
C. 步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D. 步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样a g溶于20 mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1 mol·L-1 EDTA溶液V1 mL,充分反应后稀释至250mL。
步骤二:取25.00mL上述稀释液,滴加指示剂,用c2 mol·L-1 ZnCl2溶液滴定过量的EDTA, 达到终点时消耗V2 mL ZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666g mol -1,EDTA分别能与Al3+ 或Zn2+ 以物质的量之比1:1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为___________________(用含字母的代数式表示)。计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
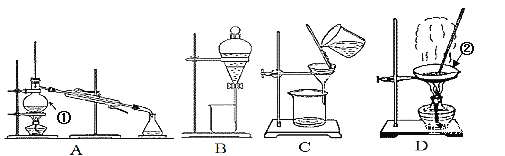
(1)装置A中仪器①的名称是______。
(2)从氯化钾溶液中得到氯化钾固体,应选择装置_____(填代表装置图的字母,下同)。
(3)分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)(已知四氯化碳和甲苯互溶),应选择装置______。
(4)从碘水中分离出I2,该装置的主要仪器名称是______,若用CCl4作为萃取剂,充分振荡后静置,观察到的现象是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,小试管内为红墨水,U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不正确的是
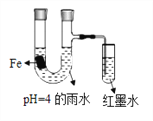
A. 生铁片中的铁是原电池的负极,发生氧化反应生成Fe2+
B. 开始时雨水酸性较强,生铁片发生析氢腐蚀
C. 墨水液面回升时,正极反应式为:O2+2H2O+4e-=4OH-
D. 如果将铁片换成铜片,也会出现开始小试管中的导管内的液面下降,一段时间后导管内的液面回升的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积可变的密闭容器中,反应2SO2(g)十O2(g) ![]() 2SO3(g)在一定条件下达到平衡,完成下列填空:
2SO3(g)在一定条件下达到平衡,完成下列填空:
(1)工业上该反应是在________(填设备名称)进行的,所用的催化剂是________。
(2)其他条件不变时,降低温度,平衡向正反应方向移动,则正反应为_______(选填“吸热”“放热”)。下图为反应速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是__________(选填编号)。

a.增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
(3)改变条件后,平衡混合物中SO3的百分含量_______(选填“增大”“减小”“不变”)。
(4)工业上用氨水来吸收SO2尾气,最终形成化肥(NH4)2 SO4,将(NH4)2 SO4固体溶于水,溶液呈_______性,理由是____________________(用离子方程式表示),该溶液体系中存在多种守恒,请任写出其中一种守恒关系(用离子浓度表示) _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是( )
A.所有物质里都含有化学键B.离子化合物中可能含有共价键
C.共价化合物中可能含有离子键D.水分子中的化学键是非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com