
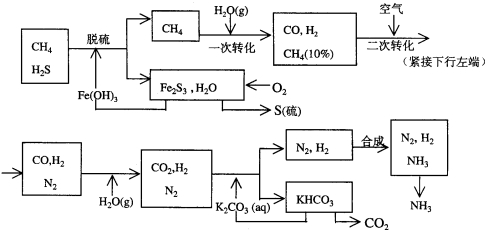
·ÖĪö øł¾Ż¹¤ŅÕĮ÷³ĢŹ¾ŅāĶ¼æÉÖŖCH4µÄµŚŅ»“Ī×Ŗ»Æ¹ż³ĢÖŠÉś³ÉĮĖCOŗĶH2£»ČżĮņ»Æ¶žĢśŗĶĖ®Ö®¼ä·“Ó¦æÉŅŌµĆµ½ĒāŃõ»ÆĢśŗĶĮņµ„ÖŹ£¬ĒāŃõ»ÆĢśæÉŅŌ²ĪÓėŃ»·Ź¹ÓĆ£»Ļņ±„ŗĶĢ¼Ėį¼ŲČÜŅŗÖŠĶØČė¶žŃõ»ÆĢ¼£¬»į²śÉśČܽā¶ČøüŠ”µÄĢ¼ĖįĒā¼ŲµÄ¾§Ģ壬Ģ¼ĖįĒā¼ŲŹÜČČ·Ö½āµĆµ½Ģ¼Ėį¼ŲŗĶĖ®ŅŌ¼°¶žŃõ»ÆĢ¼£¬Ģ¼Ėį¼ŲæÉŅŌ²ĪÓėŃ»·Ź¹ÓĆ£»µŖĘųŗĶĒāĘųÖ®¼ä·“Ó¦æÉŅŌµĆµ½°±Ęų£¬ŹōÓŚæÉÄę·“Ó¦£¬Ź£ÓąµÄµŖĘųŗĶĒāĘųæÉŅŌŃ»·Ź¹ÓĆ£»
£Ø1£©Įņ»ÆĒāŹĒĖįŠŌĘųĢ壬æÉŅŌŗĶ¼īĒāŃõ»ÆĢś·¢ÉśÖŠŗĶ·“Ó¦£»ČżĮņ»Æ¶žĢśŗĶĖ®Ö®¼ä·“Ó¦æÉŅŌµĆµ½ĒāŃõ»ÆĢśŗĶĮņµ„ÖŹ£»
£Ø2£©K2CO3£Øaq£©ŗĶCO2·“Ӧɜ³ÉĢ¼ĖįĒā¼Ų£¬Ōö“óŃ¹Ē棬»ÆŃ§Ę½ŗāĻņÓŅ½ųŠŠ£¬µĶĪĀæÉŅŌŌö“ó¶žŃõ»ÆĢ¼µÄČܽā£»
£Ø3£©ÉĻŹöĮ÷³ĢĶ¼Čż“¦Ń»·Ź¹ÓƵÄĪļÖŹŹĒµŖĘųŗĶĒāĘų”¢ĒāŃõ»ÆĢś”¢Ģ¼Ėį¼Ų£»
£Ø4£©¶žŃõ»ÆĢ¼µÄÓ¦ÓĆ£ŗÖĘøɱł£¬ÖĘ¼ī£»
£Ø5£©øł¾Ż¼×ĶéŗĶĖ®ÕōĘųÖ®¼äµÄ·“Ó¦CH4+H2O$\frac{\underline{\;øßĪĀ\;}}{\;}$CO+3H2Ą“¼ĘĖć¼“æÉ£»
£Ø6£©øł¾ŻŗĻ³É°±¹¤ŅµŌĄķ½įŗĻĮ÷³ĢÖŠŹ¹ÓĆÉč±øĄ“»Ų“š£®
½ā“š ½ā£ŗ¾Ż¹¤ŅÕĮ÷³ĢŹ¾ŅāĶ¼æÉÖŖCH4µÄµŚŅ»“Ī×Ŗ»Æ¹ż³ĢÖŠÉś³ÉĮĖCOŗĶH2£»ČżĮņ»Æ¶žĢśŗĶĖ®Ö®¼ä·“Ó¦æÉŅŌµĆµ½ĒāŃõ»ÆĢśŗĶĮņµ„ÖŹ£¬ĒāŃõ»ÆĢśæÉŅŌ²ĪÓėŃ»·Ź¹ÓĆ£»Ļņ±„ŗĶĢ¼Ėį¼ŲČÜŅŗÖŠĶØČė¶žŃõ»ÆĢ¼£¬»į²śÉśČܽā¶ČøüŠ”µÄĢ¼ĖįĒā¼ŲµÄ¾§Ģ壬Ģ¼ĖįĒā¼ŲŹÜČČ·Ö½āµĆµ½Ģ¼Ėį¼ŲŗĶĖ®ŅŌ¼°¶žŃõ»ÆĢ¼£¬Ģ¼Ėį¼ŲæÉŅŌ²ĪÓėŃ»·Ź¹ÓĆ£»µŖĘųŗĶĒāĘųÖ®¼ä·“Ó¦æÉŅŌµĆµ½°±Ęų£¬ŹōÓŚæÉÄę·“Ó¦£¬Ź£ÓąµÄµŖĘųŗĶĒāĘųæÉŅŌŃ»·Ź¹ÓĆ£»
£Ø1£©Įņ»ÆĒāŹĒĖįŠŌĘųĢ壬æÉŅŌŗĶ¼īĒāŃõ»ÆĢś·¢ÉśÖŠŗĶ·“Ó¦£ŗ3H2S+2Fe£ØOH£©3=Fe2S3+6H2O£¬µĆµ½µ„ÖŹĮņµÄ»Æѧ·½³ĢŹ½ŹĒ2Fe2S3+6H2O+3O2=4Fe£ØOH£©3+6S£»
¹Ź“š°øĪŖ£ŗ3H2S+2Fe£ØOH£©3ØTFe2S3+6H2O£»2Fe2S3+6H2O+3O2=4Fe£ØOH£©3+6S£»
£Ø2£©K2CO3£Øaq£©ŗĶCO2·“Ӧɜ³ÉĢ¼ĖįĒā¼Ų£¬Ōö“óŃ¹Ē棬»ÆŃ§Ę½ŗāĻņÓŅ½ųŠŠ£¬µĶĪĀæÉŅŌŌö“ó¶žŃõ»ÆĢ¼µÄČܽā£¬¹Ź“š°øĪŖ£ŗµĶĪĀøßŃ¹£¬ÓŠĄūÓŚŌö“ó¶žŃõ»ÆĢ¼µÄČܽā£»
£Ø3£©ÉĻŹöĮ÷³ĢĶ¼Čż“¦Ń»·Ź¹ÓƵÄĪļÖŹŹĒµŖĘųŗĶĒāĘų”¢ĒāŃõ»ÆĢś”¢Ģ¼Ėį¼Ų£¬¹Ź“š°øĪŖ£ŗĒāŃõ»ÆĢś”¢Ģ¼Ėį¼Ų”¢ŗĻ³É°±Ź±Ī“·“Ó¦ĶźµÄµŖĘųŗĶĒāĘų£»
£Ø4£©Ģ¼ĖįĒā¼Ų·Ö½āµĆµ½µÄCO2æÉÓĆÓŚÖĘøɱł£¬ÖĘ¼ī£¬¹Ź“š°øĪŖ£ŗÖĘøɱł£¬ÖĘ¼ī£»
£Ø5£©¼×ĶéŗĶĖ®ÕōĘųÖ®¼äµÄ·“Ó¦CH4+H2O$\frac{\underline{\;øßĪĀ\;}}{\;}$CO+3H2£¬Ņ»Ńõ»ÆĢ¼ŗĶĒāĘųÕ¼90%£¬ÉčCOĢå»żŹĒx£¬Ōņx+3x=90%£¬½āµĆx=0.225£¬ĖłŅŌŅ»“Ī×Ŗ»ÆŗóCOĖłÕ¼Ģå»ż±ČŹĒ22.5%£¬¹Ź“š°øĪŖ£ŗ22.5%£»
£Ø6£©ŗĻ³É°±Éś²śÖ÷ŅŖÉč±øÓŠŃ¹Ėõ»ś”¢ŗĻ³ÉĖž”¢ČČ½»»»Ę÷”¢Ė®ĄäĘ÷”¢°±ĄäĘ÷”¢°±·ÖĄėĘ÷£¬¹Ź“š°øĪŖ£ŗŃ¹Ėõ»ś”¢ŗĻ³ÉĖž”¢ČČ½»»»Ę÷”¢Ė®ĄäĘ÷”¢°±ĄäĘ÷”¢°±·ÖĄėĘ÷£ØĢīŠ“ĘäÖŠČżøö¼“æÉ£©£®
µćĘĄ ±¾ĢāŹĒŅ»µĄ»ÆѧŗĶ¹¤ŅµÉś³ÉĻą½įŗĻµÄĢāÄ棬漲éѧɜ·ÖĪöŗĶ½ā¾öĪŹĢāµÄÄÜĮ¦£¬ÄŃ¶Č½Ļ“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČĖ® | B£® | ÄĘ | C£® | ÅØĻõĖį | D£® | ÅØŃĪĖį |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| 25”ꏱ | pH[] |
| ±„ŗĶH2SČÜŅŗ | 3.9 |
| SnS³ĮµķĶźČ« | 1.6 |
| FeSæŖŹ¼³Įµķ | 3.0 |
| FeS³ĮµķĶźČ« | 5.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | X | Y | 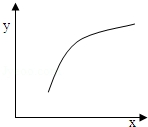 |
| A | ĪĀ¶Č | ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄĆÜ¶Č | |
| B | AµÄĪļÖŹµÄĮæ | BµÄ×Ŗ»ÆĀŹ | |
| C | “߻ƼĮµÄÖŹĮæ | CµÄĢå»ż·ÖŹż | |
| D | ¼ÓČėArµÄĪļÖŹµÄĮæ | Äę·“Ó¦ĖŁĀŹ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| Ź±¼ä/s | 0 | 500 | 1000 | 1500 |
| c£ØN2O5£©/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A£® | 500 sÄŚN2O5·Ö½āĖŁĀŹĪŖ296”Į10-3mol•L-1•s-1 | |
| B£® | øĆĪĀ¶ČĻĀµÄ·“Ó¦Ę½ŗāŹ±N2O5µÄ×Ŗ»ÆĀŹĪŖ29.6% | |
| C£® | 1000sŗó£¬ĘäĖüĢõ¼ž²»±ä£¬½«ČŻĘ÷µÄĢå»żŃ¹Ėõµ½ŌĄ“µÄ$\frac{1}{2}$£¬Ōņc£ØN2O5£©£¼5.00mol/L | |
| D£® | ·“Ó¦“ļĘ½ŗāŗó£¬ĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶ČĘ½ŗā³£Źż½«Ōö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÉżøßĪĀ¶ČæÉŅŌĢįøßCOµÄ×Ŗ»ÆĀŹ | |
| B£® | ¼ÓČė“߻ƼĮÄÜĢįøßCOµÄ×Ŗ»ÆĀŹ | |
| C£® | ĖõŠ”·“Ó¦Ę÷ČŻ»żæÉŅŌŹ¹Ę½ŗāÕżĻņŅĘ¶Æ | |
| D£® | ŌŁ³äČėŹŹĮæH2£¬øĆ·“Ó¦Ę½ŗā³£ŹżµÄŹżÖµ»įŌö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģ¼µÄČ¼ÉÕČČŠ”ÓŚ110.5 kJ/mol | |
| B£® | ¢ŁµÄ·“Ó¦ČČĪŖ221 kJ/mol | |
| C£® | ÅØĮņĖįÓėĻ”NaOHČÜŅŗ·“Ó¦µÄÖŠŗĶČČĪŖ-57.3 kJ/mol | |
| D£® | Ļ”“×ĖįÓėĻ”NaOHČÜŅŗ·“Ӧɜ³É1 molĖ®£¬·Å³öµÄČČĮæŠ”ÓŚ57.3 kJ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com