
【题目】下列溶液的物质的量浓度的计算正确的是 ( )
A. 同浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3∶2∶1,则SO![]() 浓度3∶2∶3
浓度3∶2∶3
B. 将1 mol·L-1的NaClaq和0.5 mol·L-1的BaCl2aq等体积混合后,忽略体积变化c(Cl-)=0.75 mol·L-1
C. 将10 mL 18.4 mol·L-1的浓硫酸加水稀释至1 L,稀释后溶液中H2SO4的物质的量浓度为0.184 mol·L-1
D. 标准状况下22.4 L HCl溶于1 L水,盐酸的物质的量浓度为1 mol·L-1
【答案】C
【解析】A、假设三种溶液的浓度均为1mol/L,则Na2SO4、MgSO4、Al2(SO4)3溶液中SO42-浓度分别=1mol/L×1=1mol/L、1mol/L×1=1mol/L和1mol/L×3=3mol/L,即浓度之比为1:1:3,选项A错误;B、将1 mol·L-1的NaCl(aq)和0.5 mol·L-1的BaCl2(aq)等体积混合后,忽略体积变化c(Cl-)=![]() =0.5 mol·L-1,选项B错误;C、根据c1V1=c2V2,则有:10 ×10-3L×18.4 mol·L-1= c2×1L,解得c2=0.184 mol·L-1,选项C正确;D、标准状况下22.4 L HCl溶于1 L水,所得溶液不是1L,无法求算盐酸的物质的量浓度,选项D错误。答案选C。
=0.5 mol·L-1,选项B错误;C、根据c1V1=c2V2,则有:10 ×10-3L×18.4 mol·L-1= c2×1L,解得c2=0.184 mol·L-1,选项C正确;D、标准状况下22.4 L HCl溶于1 L水,所得溶液不是1L,无法求算盐酸的物质的量浓度,选项D错误。答案选C。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2![]() LiNH2+LiH。下列有关说法正确的是( )
LiNH2+LiH。下列有关说法正确的是( )
A. Li2NH中N的化合价是-1 B. 该反应中H2既是氧化剂又是还原剂
C. Li+和H-的离子半径相等 D. 此法储氢和钢瓶储氢的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
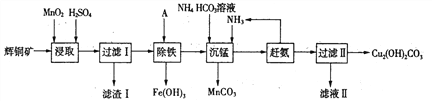
①浸取反应中氧化剂的化学式为________;滤渣I的成分为Mn02、S和_______(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2] =2.2×l0-20。)
③“沉锰”(除Mn2+)过程中反应的离子方程式___________。
④滤液Ⅱ经蒸发结晶得到的盐主要是________(写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装寘,盐桥内装载的是足量用饱和氯ft钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00g,则导线中通过了___mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差________g。
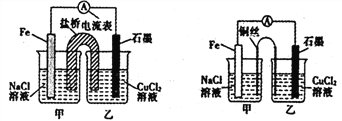
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH ___(填“减小”、“增大”或“不变”),乙池中石墨为___极(填“正”、“负”、“阴”或“阳”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B. 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
C. 氢氧化钠溶液吸收足量SO2气体:SO2 + 2OH-=SO32- + H2O
D. 标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2—=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A. B为短周期元素,两元素可形成化合物AB2,已知其原子序数分别为a和b,则a不可能为( )
A. b+4 B. b-5 C. b+6 D. b+8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 分馏石油可以得到植物油、柴油、润滑油
B. 在酒化酶的作用下葡萄糖水解为乙醇和二氧化碳
C. 乙酸、汽油、纤维素均能和氢氧化钠溶液反应
D. 在大豆蛋白溶液中,加入硫酸铜溶液,蛋白质会发生变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“心思身备”中提到的锶是一种银白色带黄色光泽的碱土金属(第ⅡA族)。是碱土金属(除铍外)中丰度最小的元素,在自然界以化合态存在,可由电解熔融的氯化银而制得。
(1)锶和钙都位于第IIA主族,具有相似的化学性质,锶比钙的金属性更强,它们的单质都能和水反应放出氢气。锶与水反应的化学方程式为:____________________________________
(2)颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应那么剧烈,原因是____________________
(3)锶在一定条件下分别与O2、N2、H2发生反应,生成X、Y、Z三种锶的化合物,X与酸反应、 Y、Z与水反应均可放出气体。
①X与盐酸反应的化学方程式为:___________________________
②0.01molY溶于100mL盐酸(足量)恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为_____________________________
③Z的电子式为:_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中,正确的是

A. 1mol该物质分别与浓溴水和H2反应时分别最多消耗4mol和7mol
B. 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C. 该物质与苯酚属于同系物,遇溶液呈紫色
D. 该分子中的所有碳原子不可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com