
分析 根据n=cv计算500ml 0.4mol/L的盐酸溶液中含HCl的物质的量,根据v=nVm计算HCl标准状况下的体积,根据m=nM计算HCl的质量,HCl是强电解质,完全电离,氯离子物质的量等于HCl的物质的量;c(Cl-)=c(HCl)、c(Cl-)=2c(CaCl2)计算Cl-浓度相等的CaCl2溶液的浓度,从该溶液中取出20毫升溶液,加水稀至80毫升,根据稀释定律求解稀释后溶液的物质的量浓度.
解答 解:500ml 0.4mol/L的盐酸溶液中含HCl的物质的量n=cv=0.4mol/L×0.5L=0.2mol,HCl标准状况下的体积v=nVm=0.2mol×22.4L/mol=4.48L,含HCl质量为m=nM=0.2mol×36.5g/mol=7.3g,盐酸中c(Cl-)=c(HCl)=0.4mol/L,CaCl2溶液中c(Cl-)=2c(CaCl2),所以Cl-浓度相等的CaCl2溶液的浓度0.2mol/L,从该溶液中取出20毫升溶液,加水稀至80毫升,稀释后溶液的物质的量浓度,根据C浓×V浓=C稀×V稀,0.4mol/L×20ml=C稀×80ml,解得:C稀=0.1mol/L,
故答案为:0.2;4.48;7.3;0.2;0.1mol/L.
点评 本题考查物质的量的有关计算,侧重考查计算能力,明确物质的量公式中各个物理量的关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 食盐、稀醋酸和蔗糖都是电解质 | |
| B. | 甲烷和乙烯均可使酸性KMnO4溶液褪色 | |
| C. | 纤维素、淀粉和蛋白质都是高分子化合物 | |
| D. | 乙酸乙酯和植物油均可水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
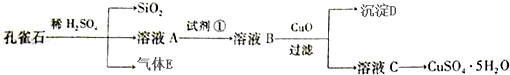
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1=△H2 | B. | △H1>△H2 | C. | △H2>△H1 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对溶液所在体系加热,溶液蓝色加深 | |
| B. | 对溶液所在体系用冰水降温,上述反应的平衡常数减小 | |
| C. | 室温下,加水稀释至一定范围,溶液为蓝色 | |
| D. | 室温下,加水稀释至一定范围,溶液为粉红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使红色石蕊试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是
,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是 ,最高价氧化物的水化物酸性最强的酸的化学式是HClO4;
,最高价氧化物的水化物酸性最强的酸的化学式是HClO4; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 油脂在酸性条件下可水解生成高级脂肪酸和甘油 | |
| C. | 淀粉、油脂、氨基酸都能水解,但水解产物不同 | |
| D. | 合成橡胶与光导纤维都属于有机高分子材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com