
| A、①④⑤⑥ | B、①②③④ |
| C、③④⑤⑥ | D、②④⑤⑥ |


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| A、c (K+)>c (NO3-)>c (Ag+)=c (Cl-)+c (I-) |
| B、c (K+)>c (NO3-)>c (Ag+)>c (Cl-)>c (I-) |
| C、c (NO3-)>c (K+)>c (Ag+)>c (Cl-)>c (I-) |
| D、c (K+)>c (NO3-)>c (Cl-)>c (Ag+)>c (I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16g14CH4所含中子数目为8NA |
| B、1 mol-CH3含有9 NA个电子 |
| C、常温常压下,44 g CO2气体含有氧原子的个数为2 NA |
| D、46gNO2和N2O4的混合物含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氯甲烷有两种同分异构体 |
| B、丙烷的二氯代物有四种同分异构体,则其六氯代物也有四种同分异构体 |
| C、(CH3CH2)2CHCH3一氯取代物有两种同分异构体 |
| D、烷烃失去一个氢原子剩余的原子团叫烷基,苯环上的氢原子被烷基取代后、和苯分子相差若干CH2的物质是苯的同系物,则苯的同系物C8H10有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol 氧气中含有6.02×1023个氧原子,在标准状况下占有体积22.4 L |
| B、1 mol臭氧和1.5 mol氧气含有相同的氧原子数 |
| C、等体积、浓度均为1 mol/L的硫酸和盐酸,电离出的氢离子数之比为2:1 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 的沸点比
的沸点比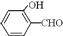 高,原因是
高,原因是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50mL 0.2mol?L-1 的 NaCl 溶液 |
| B、100mL 0.1mol?L-1 的 NaCl 溶液 |
| C、25mL 0.2mol?L-1 的 Na2SO4 溶液 |
| D、10mL 0.5mol?L-1 的 Na2CO3 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
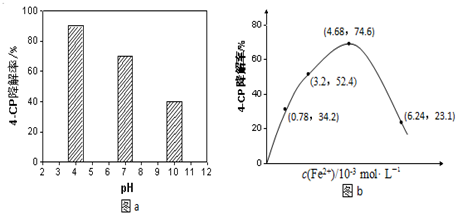
查看答案和解析>>
科目:高中化学 来源: 题型:
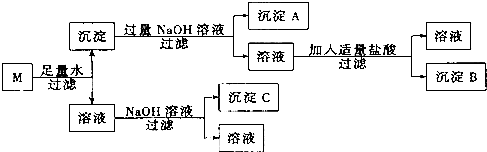
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com