
| A、用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| B、碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3?H2O+H2O |
| C、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| D、Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
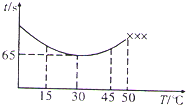 NaHSO4可被过量KIO3氧化,当NaHSO3.完全消耗时即有I2析出.某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素.
NaHSO4可被过量KIO3氧化,当NaHSO3.完全消耗时即有I2析出.某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素.| 实验编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 10 | 15 | a | 10 | t1 |
| ② | 10 | 30 | 0 | 10 | t2 |
| ③ | 10 | b | 0 | 20 | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后C(Cl-):C(ClO-)=11,则溶液中C(ClO-):C(ClO3-)=
| ||||
B、参加反应的氯气的物质的量等于
| ||||
C、改变温度,反应中转移电子的物质的量n的范围:
| ||||
D、改变温度,产物中KC1O3的最大理论产量为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
235 92 |
235 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、直径介于1~10nm之间的微粒称为胶体 |
| B、NaOH溶液中滴加FeCl3溶液制得Fe(OH)3胶体 |
| C、利用丁达尔效应可以区别溶液与胶体 |
| D、过滤可以分离胶体粒子与溶液中的溶质粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
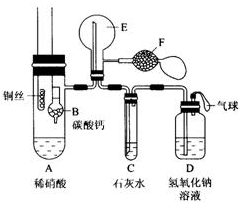 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去).B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为 一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去).B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为 一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球. 查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| n(CIO-) | ||
n(CI
|
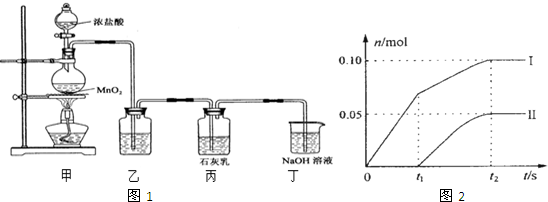
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
| A、等物质的量浓度的各溶液pH关系为:pH(NaClO)>pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) |
| B、向NaClO溶液中通入少量CO2气体反应为:ClO-+H2O+CO2=HClO+HCO3- |
| C、等物质的量浓度的HClO稀溶液与NaOH稀溶液等体积混合后溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+) |
| D、Na2CO3和NaHCO3混合液中,一定有:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
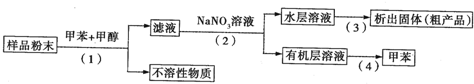
| A、步骤(1)需要过滤装置 |
| B、活性物质易溶于有机溶剂,难溶于水 |
| C、步骤(3)需要用到蒸发皿 |
| D、步骤(4)是利用物质的沸点差异进行分离的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com