
【题目】铝的某种超原子结构(Al13)具有40个价电子时最稳定。请预测稳定的Al13所带的电荷数为( )
A.+1B.0C.﹣1D.﹣2
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的2 L的密闭容器中,加入3 mol A和1 mol B,发生如下反应:3A(g)+B(g)![]() 2C(g)+3D(s),5 min达到平衡时,n(B):n(C) =1:3。
2C(g)+3D(s),5 min达到平衡时,n(B):n(C) =1:3。
(1)0~5 min内用B表示的平均反应速率为_______;达到平衡时,A的转化率为_______。
(2)达到平衡时容器内气体压强与反应前容器内气体压强之比_________。
(3)维持容器的温度不变,若缩小容器的体积,则平衡将向_____(填“正向移动”“逆向移动”或“不移动”)。
(4)达到平衡后,若保持温度不变,将C从容器中分离出一部分,则化学平衡常数____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 0.1mo1·L-1NH4HS溶液中有:c(NH4+)<c(HS-)+c(S2-)+c(H2S)
B. 25℃时,将a mo1·L-1的氨水与0.01 mo1·L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3·H2O的电离常数为![]()
C. 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN)
D. 等pH的HA和HB溶液,分别与一定浓度的氢氧化钠溶液完全中和,HA消耗的氢氧化钠溶液体积多,则可证明酸性HA<HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为______________________________________________。
(2)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成盐的化学方程式是_______。
(4)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为_____________,②④两种元素形成原子数目比为1∶2的共价化合物的结构式为___________________________。
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为_________,⑨的最高价氧化物的水化物的浓溶液与铜反应的化学方程式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
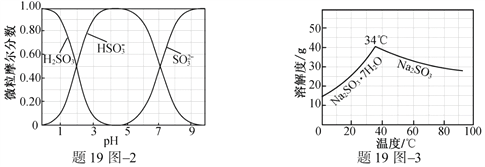
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两元素是同周期的非金属元素,如果X 原子半径比Y的大,下面说法正确的是 ( )
A.最高价氧化物对应的水化物的酸性,X的比Y的强
B.X的非金属性比Y的强
C.X的阴离子比Y的阴离子还原性强
D.X的气态氢化物比Y的稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种强氧化性气体(高浓度时呈红黄色,低浓度时呈黄色),在消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过下图所示装置(夹持装置略)对其进行制备、收集、吸收并制取NaClO2。
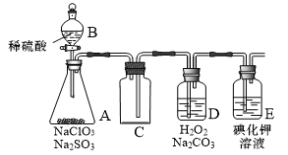
(1)仪器A的名称是______。
(2)图中装置有一明显错误,请指出:______。
(3)打开B的活塞,A中有ClO2生成,D中吸收ClO2后生成NaClO2和NaHCO3,写出D中所发生反应的离子方程式:______。
(4)E中溶液出现黄色能否说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,判断并说明理由:______。
(5)写出一种提高ClO2吸收率的方法:______。
(6)E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO2—,当pH≤2.0时,ClO2—能被I—还原。请补充完整检验E装置溶液中存在少量ClO2—的实验方案:取一定体积E装置中的溶液于分液漏斗中,______,则溶液中存在ClO2—。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL0.1 mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL。下列叙述正确的是
A. x=10时, 溶液中有NH4+、AlO2-、SO42-, 且c(NH4+)>c(SO42-)
B. x=10时, 溶液中有NH4+、Al3+、SO42-, 且c(NH4+)>c(Al3+)
C. x=30时, 溶液中有Ba2+、AlO2-、OH-, 且c(OH-)<c(AlO2-)
D. x=30时, 溶液中有Ba2+、Al3+、OH-, 且c(OH-)=c(Ba2+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com