
 .
. .
. .
.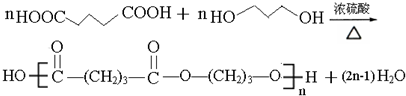 .
. (写出其中一种结构简式).
(写出其中一种结构简式).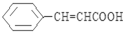 )的合成路线示意图.
)的合成路线示意图.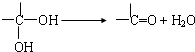
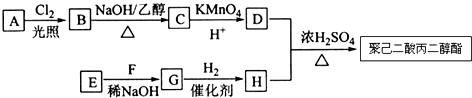
分析 烃A的相对分子质量为84,碳原子最大数目为$\frac{84}{12}$=7,故A为C6H12,核磁共振氢谱显示只有一种化学环境的氢,则A的结构简式为 ,A发生光照下取代反应生成一氯代烃B为
,A发生光照下取代反应生成一氯代烃B为 ,B发生消去反应生成C为
,B发生消去反应生成C为 ,C发生氧化反应生成D为HOOC(CH2)4COOH,E、F为相对分子质量差14的同系物,F是福尔马林的溶质,则F为HCHO,可知E为CH3CHO,由信息④可知E与F反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成聚己二酸丙二醇酯为
,C发生氧化反应生成D为HOOC(CH2)4COOH,E、F为相对分子质量差14的同系物,F是福尔马林的溶质,则F为HCHO,可知E为CH3CHO,由信息④可知E与F反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成聚己二酸丙二醇酯为 .
.
(6)甲苯与氯气在光照条件下发生取代反应生成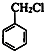 ,在碱性条件下水解生成
,在碱性条件下水解生成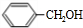 ,发生催化氧化生成
,发生催化氧化生成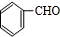 ,与乙醇发生加成反应生成
,与乙醇发生加成反应生成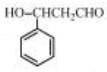 ,发生消去反应生成
,发生消去反应生成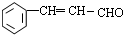 ,最后被银氨溶液氧化生成
,最后被银氨溶液氧化生成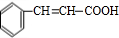 .
.
解答 解:烃A的相对分子质量为84,碳原子最大数目为$\frac{84}{12}$=7,故A为C6H12,核磁共振氢谱显示只有一种化学环境的氢,则A的结构简式为 ,A发生光照下取代反应生成一氯代烃B为
,A发生光照下取代反应生成一氯代烃B为 ,B发生消去反应生成C为
,B发生消去反应生成C为 ,C发生氧化反应生成D为HOOC(CH2)4COOH,E、F为相对分子质量差14的同系物,F是福尔马林的溶质,则F为HCHO,可知E为CH3CHO,由信息④可知E与F反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成聚己二酸丙二醇酯为
,C发生氧化反应生成D为HOOC(CH2)4COOH,E、F为相对分子质量差14的同系物,F是福尔马林的溶质,则F为HCHO,可知E为CH3CHO,由信息④可知E与F反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成聚己二酸丙二醇酯为 .
.
(1)由上述分析可知,A的结构简式为 ,故答案为:
,故答案为: ;
;
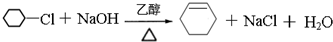
(2)B的结构简式为 ,B生成C是卤代烃的消去反应,所以由B生成C的化学方式为
,B生成C是卤代烃的消去反应,所以由B生成C的化学方式为 ,
,
故答案为: ;
;
(3)由E和F生成G是醛基的加成反应生成HOCH2CH2CHO,G的化学名称为3-羟基丙醛,
故答案为:加成反应;3-羟基丙醛;
(4)①G与氢气发生加成反应生成H为HOCH2CH2CH2OH.D是己二酸,则由D和H生成聚已二酸丙二醇酯的化学方程式为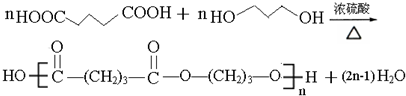 ,
,
故答案为: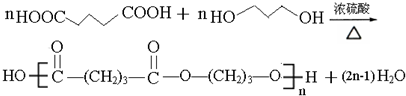 ;
;
②根据结构简式可知链节的式量是184,所以若聚已二酸丙二醇酯平均相对分子质量为5600,则其平均聚合度约为5600÷184=30,
故答案为:a;
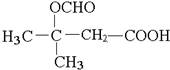
(5)D为HOOC(CH2)4COOH,同分异构体符合:①能与饱和NaHCO3溶液反应产生气体,说明含有羧基;②既能发生银镜反应,又能发生水解反应,说明含有醛基和酯基,因此是甲酸形成的酯基,可以看做丁烷中2个H原子被-OOCH、-COOH取代,看作丁烷中2个H原子被-COOH、-OOCH取代,若为CH3CH2CH2CH3被取代,-COOH取代甲基中H原子,-OOCH有4种位置,-COOH取代亚甲基中H原子,-OOCH有4种位置,若为CH(CH3)3被取代,-COOH取代甲基中H原子,-OOCH有3种位置,-COOH取代次甲基中H原子,-OOCH有1种位置(其它两种重复),故共有4+4+3+1=12种,其中核磁共振氢谱显示为4组峰,且峰面积比为6:1:1:2的是 ,
,
故答案为:12; ;
;
(6)甲苯与氯气在光照条件下发生取代反应生成 ,在碱性条件下水解生成
,在碱性条件下水解生成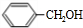 ,发生催化氧化生成
,发生催化氧化生成 ,与乙醇发生加成反应生成
,与乙醇发生加成反应生成 ,发生消去反应生成
,发生消去反应生成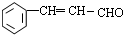 ,最后被银氨溶液氧化生成
,最后被银氨溶液氧化生成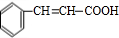 ,合成路线流程图为:
,合成路线流程图为: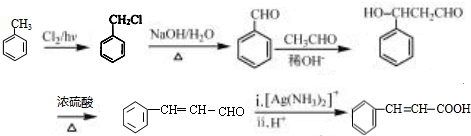 ,
,
故答案为: .
.
点评 本题考查有机物合成与推断、有机物命名、有机反应类型、化学方程式书写、有机物结构、同分异构体判断以及高分子化合物计算等,关键是计算确定A的结构简式,再结合反应条件进行推断,需要学生熟练掌握官能团的性质与转化,侧重分析与推断能力的综合考查,同分异构体书写为易错点、难点,注意利用取代法与定一移一法解答,题目难度中等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾在水中形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 氧化铝常被用于制作作耐火材料 | |
| C. | Fe2O3俗称铁红,常用作红色的油漆和涂料 | |
| D. | Na2O2具有强氧化性,不能用作呼吸面具中的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子.回答下列问题:
原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
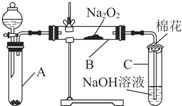 为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入1mol•L-1盐酸,再滴加1mol•L-1BaCl2溶液 | 有白色沉淀生成,则证明生成物中含Na2SO4, |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中加入2~3滴0.01mol•L-1KMnO4酸性溶液, | |
| 振荡 | 若KMnO4溶液紫红色褪去,则证明生成物中有Na2SO3;, |
| 则证明生成物中有Na2SO3;若 | |
| 若KMnO4溶液紫红色不褪去, | |
| 则说明生成物中没有Na2SO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性强弱:R>W>X | |
| C. | Y的氢化物比R的氢化物稳定,熔沸点高 | |
| D. | Y与Z形成的两种化合物中阴、阳离子的个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com