
| ||
| 16g |
| 160g/mol |
| a |
| 2 |
| a |
| 2 |


科目:高中化学 来源: 题型:
| A、Fe(NO3)3加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、硫酸镁溶液与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
| C、等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、Cu溶于足量稀硝酸:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | (Ⅰ) | (Ⅱ) |
| A | 少量H2SO4(aq)滴入Ba(OH)2(aq)中 | 少量NaHSO4(aq)滴入Ba(OH)2(aq)中 |
| B | 少量NaOH(aq)滴入Al2(SO4)3(aq)中 | 少量Al2(SO4)3滴入氨水中 |
| C | 少量Ca(HCO3)2(aq)滴入Ca(OH)2(aq)中 | 少量Ca(OH)2(aq)滴入Ca(HCO3)2(aq)中 |
| D | 少量盐酸滴入Na2CO3(aq)溶液中 | 少量Na2CO3(aq)滴入盐酸中 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
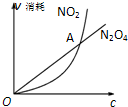 已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )
已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )| A、图中A点对应的状态表示该反应达到化学平衡 |
| B、若某温度时k1=k2,则该温度下反应的平衡常数K=0.5 |
| C、在1L密闭容器中充入1 mol NO2,平衡时:c(NO2)+c(N2O4)=1 mol?L-1 |
| D、在1L密闭容器中充入1 mol NO2,当c(NO2)=c(N2O4)时,NO2的转化率是33.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
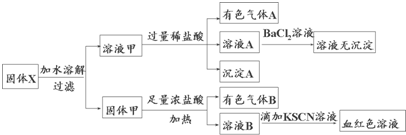
| A、溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2 |
| B、由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3 |
| C、气体A和气体B一定均为纯净物 |
| D、原混合物中一定含有Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
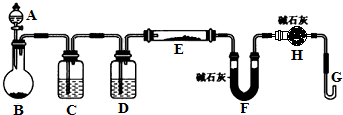 某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:| ①空E管的质量a; | ④反应前F管及内盛物的总质量d; |
| ②E管和WO3的总质量b; | ⑤反应后F管及内盛物的总质量e |
| ③反应后E管和W粉的总质量c(冷却后); |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气体 | 烧瓶和气体的总质量(g) |
| A | 48.4082 |
| B | 48.4082 |
| C | 48.4082 |
| D | 48.4342 |
| E | 48.8762 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C 1s22s22p2 |
| B、O2- 1s22s22p6 |
| C、Cr 1s22s22p63s23p63d44s2 |
| D、Al 3+ 1s22s22p6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com