
 (1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡的标志是
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡的标志是| n |
| c |
| 0.3mol |
| 0.15mol/L |
| c(C) |
| t |
| 0.06mol/L |
| 15s |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
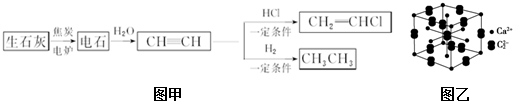
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇 | B、氯仿 | C、乙醛 | D、苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素周期表含7个主族,8个副族和0族,共16个族 |
| B、金属元素的种类比非金属元素多 |
| C、元素周期表共七个周期,1-4为短周期,5-7为长周期 |
| D、科学家在周期表中金属与非金属的分界线处找到了优良的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤ | B、②④⑤⑥ |
| C、②③④⑤ | D、①③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com