
【题目】根据如图回答,下列说法不正确的是
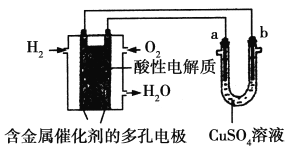
A. 此装置用于铁表面镀铜时,a为铁
B. 此装置用于电镀铜时,硫酸铜溶液的浓度不变
C. 燃料电池中正极反应为1/2O2+2e-+2H+===H2O
D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
【答案】A
【解析】
试题氢氧燃料电池中,通入氢气的电极一定是负极,通入氧气的电极一定是正极,和正极相连的是电解池的阳极,和负极相连的是电解池的阴极;电镀时,电解质溶液中离子浓度不变,电解精炼铜时,粗铜作阳极,精铜作阴极,根据得失电子守恒进行计算.
解:氢氧燃料电池中,通入氢气的电极一定是负极,通入氧气的电极一定是正极,故b极为阴极,a极为阳极.
A、铁表面镀铜时,金属铜必须作阳极,金属铁作阴极,所以a为金属铜,故A错误;
B、此装置用于电镀铜时,金属铜必须作阳极,电解前后硫酸铜溶液的浓度不变,故B正确;
C、氢氧燃料电池中,通入氧气的电极一定是正极,在酸性环境下,氧气放电的反应为:![]() O2+2H++2e﹣=H2O,故C正确;
O2+2H++2e﹣=H2O,故C正确;
D、电解精炼铜时,粗铜作阳极,精铜作阴极,1mol水生成,转移2mol电子,可得到64g铜,故D正确.21世纪教育网
故选A.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
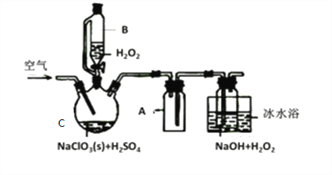
(1)仪器C的名称是__________________,仪器A的作用是_________________,冰水浴冷却的目的是_____________________和___________________________。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,___________;空气流速过快时,________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①_____________________________(用离子方程式表示)
②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为_________________。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量的混合气体发生反应:xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L.下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L.下列有关判断正确的是( )
A. 平衡向正反应方向移动 B. B的转化率降低
C. x+y<z D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是最常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化
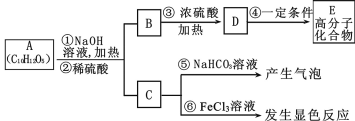
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为:
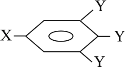 (其中:—X、—Y均为官能团)
(其中:—X、—Y均为官能团)
请回答下列问题:
(1)官能团-X的名称为____,反应③的类型为____;
(2)根据系统命名法,B的名称为____,高聚物E的链节为____;
(3)A的结构简式为____;
(4)反应⑤的化学方程式为____;
(5)C有多种同分异构体,其中符合下列要求的同分异构体共____种;
i.含有苯环 ii.能发生银镜反应 iii.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是____(填序号)。
a 含有苯环 b 含有羰基 c 含有酚羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用bmol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O62-。
试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少________________________。
(2)滴定操作时,左手控制滴定管,右手__________,眼睛要注视__________。
(3)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由__________色变为__________色。
(4)水中溶解氧的计算式是__________(以g/L为单位)。
(5)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果__________(填“偏高”“偏低”或“无影响”,下同)。
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
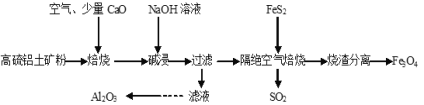
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图,下列说法中不正确的是

A. 甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
B. 若乙池中为足量AgNO3溶液,则阳极的电极反应为: 4OH--4e-= 2H2O+O2↑
C. 甲池中随着反应的不断进行,溶液的pH减小
D. 若乙池中为一定量CuSO4溶液,通电一段时间后,向溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法正确的是
A.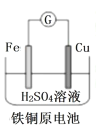 Fe 棒为负极,电极反应为 Fe-3e-= Fe3+
Fe 棒为负极,电极反应为 Fe-3e-= Fe3+
B.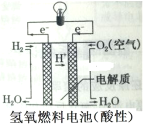 能够给用电器提供电势差,是由于两个电极上有得失电子能力不同的氢气和氧气
能够给用电器提供电势差,是由于两个电极上有得失电子能力不同的氢气和氧气
C. 锌筒作负极,发生还原反应,锌筒会变薄
锌筒作负极,发生还原反应,锌筒会变薄
D.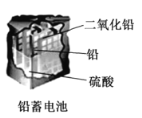 使用一段时间后硫酸铅沉淀在电极板上,溶液酸性减弱,导电能力下降
使用一段时间后硫酸铅沉淀在电极板上,溶液酸性减弱,导电能力下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com