
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | 反应容器中密度不随时间变化而变化 | |
| C. | 混合气体颜色深浅保持不变 | |
| D. | NO2、NO、O2的物质的量浓度之比为2:2:1 |
分析 可逆反应2NO(g)+O2(g)?2NO2(g)为气体体积缩小的反应,该反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.
解答 解:A.正反应生成NO2的速率和逆反应生成O2的速率相等,不满足计量数关系,说明该反应没有达到平衡状态,故A错误;
B.反应前后气体质量守恒,容器体积不变,密度始终不变,不能根据密度判断平衡状态,故B错误;
C.当反应达到平衡状态时,二氧化氮的浓度不变,则混合气体颜色深浅不变,故C正确;
D.NO2、NO、O2的物质的量浓度之比为2:2:1,无法判断各组分的浓度是否不再变化,则无法判断是否达到平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,本题中可根据反应前后气体颜色变化,浓度不变来判断是否达到平衡状态.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO${\;}_{3}^{-}$、Cl- | B. | Fe3+、SCN-、Cl-、SO${\;}_{4}^{2-}$ | ||
| C. | NH${\;}_{4}^{+}$、Fe2+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | D. | Mg2+、Fe2+、SO${\;}_{4}^{2-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
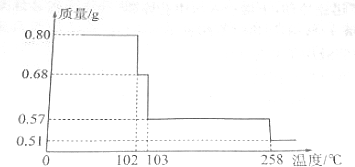
 图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AsH3>NH3>PH3 | B. | PH3>AsH3>NH3 | C. | NH3>PH3>AsH3 | D. | NH3>AsH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和HCOOH均属于弱电解质 | B. | CO2和HCOOH均属于有机化合物 | ||
| C. | CO2转变为HCOOH发生还原反应 | D. | 1mol CO2的体积一定等于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
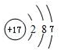 ,最高价氧化物的化学式为:Cl2O7.
,最高价氧化物的化学式为:Cl2O7.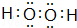 .
.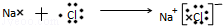 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
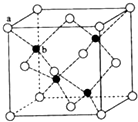 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com