
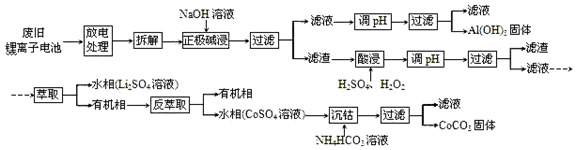
分析 废旧锂离子电池放电处理拆解后正极用氢氧化钠溶液碱溶过滤得到滤液调节溶液PH过滤得到氢氧化铝沉淀;滤渣加入硫酸,过氧化氢调节溶液PH过滤得到滤液加入萃取剂萃取分液得到水层为硫酸锂,有机层通过反萃取得到水层硫酸钴溶液加入碳酸氢铵溶液沉淀钴离子得到碳酸钴固体;
(1)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成;
(2)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀;
(3)充电时,LiCoO2和C发生氧化还原反应生成Li1-xCoO2和LixC6;
(4)“放电处理”有利于锂在正极的回收,Li+从负极中脱出,经由电解质向正极移动,在整个回收工艺中,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4.
解答 解:(1)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+3H2SO4+H2O2$\frac{\underline{\;\;△\;\;}}{\;}$Li2SO4+2CoSO4+O2↑+4H2O;2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑;由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,污染较大;
故答案为:2LiCoO2+3H2SO4+H2O2$\frac{\underline{\;\;△\;\;}}{\;}$Li2SO4+2CoSO4+O2↑+4H2O;2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑;有氯气生成,污染较大;
(2)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀、硫酸铵、二氧化碳和水,反应方程式为CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O;
故答案为:CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O;
(3)充电时,LiCoO2和C发生氧化还原反应生成Li1-xCoO2和LixC6,反应方程式为:LiCoO2+6C=Li1-xCoO2+LixC6;
故答案为:LiCoO2+6C=Li1-xCoO2+LixC6;
(4)放电时,负极上生成锂离子,锂离子向正极移动并进入正极材料中,所以“放电处理”有利于锂在正极的回收,根据流程图知,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4;
故答案为:Li+从负极中脱出,经由电解质向正极移动并进入正极材料中;Al(OH)3、CoCO3、Li2SO4.
点评 本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、电化学等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,难度中等.


科目:高中化学 来源: 题型:选择题
| A | C | |
| B |
| A. | B为第二周期的元素 | B. | C为第五主族元素 | ||
| C. | A的原子序数为6 | D. | C是非金属性最强的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 贮氢金属并不是简单地吸附氢气,而是通过化学反应贮存氢气 | |
| B. | 物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化 | |
| C. | 石油分馏的馏分之一是石油气,石油气含有大量的己烷 | |
| D. | 使用煤液化的产品作燃料与直接燃烧煤比较,对保护环境有利,目前,煤液化的唯一途径是将煤在高温和催化剂条件下与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+H+=HCO3- | B. | HCO3-+3CO32-+7H+═4CO2↑+4H2O | ||
| C. | 2HCO3-+5CO32-+12H+═7CO2↑+7H2O | D. | HCO3-+CO32-+3H+═2CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| B. | 推广“低碳经济”,减少温室气体的排放 | |
| C. | CO2、CH4、N2等均是造成温室效应的气体 | |
| D. | 利用晶体硅制作的太阳能电池可将太阳能直接转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水淡化------蒸馏 | |
| B. | 将碘单质从沙子提取出来--------过滤 | |
| C. | 盐水中获得食盐--------萃取分液 | |
| D. | 稀释浓硫酸时将水慢慢加入浓硫酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
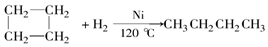
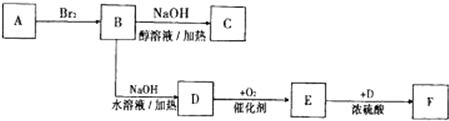
 ;C
;C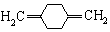 ;
;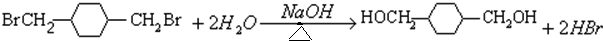 ;E→F:
;E→F: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的Fe2+全部作还原剂 | |
| B. | 生成1.5molFe3O4时,反应转移电子 6mol电子 | |
| C. | 方程式中a=2 | |
| D. | 反应中被氧化的元素是Fe,被还原的元素是S和O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com