
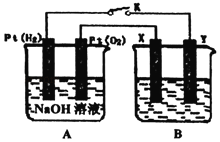
【题目】某化学兴趣小组用如图所示装置进行电化学原理的实验探究,冋答下列问题:
(1)通入O2的Pt电极为电池的_____(填“正极”或“负极”),电极反应式为_____。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为_____(填“镀件”或“银”)。
(3)若B电池的电解质溶液为500mL1.0molL﹣1的NaCl溶液(滴有少量紫色石蕊试液),X、Y皆为惰性电极,电池工作过程中发现X极溶液先变红后局部褪色,解释原因_____。当电池工作一段时间后断开K,Y极共收集到560mL气体(标准状况),此时B池中溶液的pH=_____(假设溶液体积不变),转移电子的数目为_____。
【答案】正极 O2+4e﹣+2H2O=4OH﹣ 银 X电极产生的Cl2与水反应产生的HCl和HClO使溶液显酸性,同时HClO有漂白性 13 0.05NA
【解析】
在如图所示的装置中,A装置是燃料电池,A装置通入H2的电极为负极,通入O2的电极为正极;B装置是电解池,X与电源的正极相连,是阳极发生氧化反应,Y与电源的负极相连,是阴极发生还原反应。
(1) 在如图所示的装置中,A装置是燃料电池, B装置是电解池,其中对于A装置来说,通入O2的电极为正极,正极得到电子,发生还原反应,电极方程式为O2+4e-+2H2O=4OH-;
(2) X与电源的正极相连,是阳极发生氧化反应,所以X电极材料为银;
(3) X是阳极,发生反应:2Cl--2e-=Cl2↑,Cl2与水反应产生的HCl和HClO,使溶液显酸性石蕊变红,同时HClO有强氧化性使红色褪去,所以原因为:X电极产生的Cl2与水反应产生的HCl和HClO使溶液显酸性,同时HClO有漂白性;Y极生成氢气,n(H2)=![]() =0.025mol,根据电解总反应方程式:2NaCl+2H2O
=0.025mol,根据电解总反应方程式:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH可知:每产生1mol氢气,会同时产生2molNaOH,由于n(H2)=0.025mol,所以n(NaOH)=2×0.025mol=0.05mol,溶液的体积是500 mL,则c(NaOH)=
Cl2↑+H2↑+2NaOH可知:每产生1mol氢气,会同时产生2molNaOH,由于n(H2)=0.025mol,所以n(NaOH)=2×0.025mol=0.05mol,溶液的体积是500 mL,则c(NaOH)=![]() =0.1mol/L,所以pH=13;根据反应方程式生成的Cl2为0.025mol,结合2Cl--2e-=Cl2↑,则转移电子为2×0.025mol=0.05mol,数目为0.05NA。
=0.1mol/L,所以pH=13;根据反应方程式生成的Cl2为0.025mol,结合2Cl--2e-=Cl2↑,则转移电子为2×0.025mol=0.05mol,数目为0.05NA。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】医药阿斯匹林的结构简式如图。试回答:
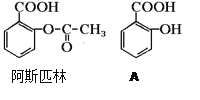
(1)阿斯匹林可看成酯类物质,口服后在胃肠作用下,阿斯匹林发生水解反应,生成A和B两种产物。其中A的结构简式如图,则阿斯匹林的分子式为:______________B的结构简式为:_______B中的官能团是:______________(名称)
⑵上述水解产物B与甲醇、浓硫酸共热反应的化学方程式为:_____________________________________________________
⑶ 甲醇在铜作催化剂时与氧气反应的化学方程式为:______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):
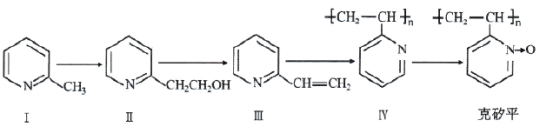
(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以一定条件下与氢气发生反应生成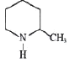 :该反应类型为______。
:该反应类型为______。
(2)已知化合物Ⅰ生成化合物Ⅱ是原子利用率 100%的反应,则所需另一种反应物的分子式为_____。
(3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正确的是_____(填字母)。
A.化合物Ⅱ可以与CH3COOH发生酯化反应
B.化合物Ⅱ不可以与金属钠生成氢气
C.化合物Ⅲ可以使溴的四氯化碳溶液褪色
D.化合物Ⅲ不可以使酸性高锰酸钾溶液褪色
(4)下列化合物中,能发生类似于“Ⅲ→Ⅳ”反应的是(__________)
A.乙烷 B.乙烯 C.乙醇 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是(已知酮基只与氢气加成,与Br2不反应)( )
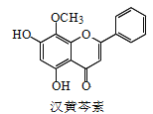
A.汉黄芩素的分子式为C16H13O5
B.该物质遇FeCl3溶液显色
C.1mol该物质与溴水反应,最多消耗1molBr2
D.与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油化工产品1,3-丁二烯合成化工中间产品D (![]() )的合成路线如下:
)的合成路线如下:
已知:

(1)物质D中所含官能团名称为_________,一定条件下,1 molD最多与_________molH2发生加成反应。
(2)写出②⑥的反应类型分别是_________、_________。
(3)④反应的化学方程式_________。⑤反应的化学方程式_________。
(4)A 的系统命名是_________。
(5)写出与物质D互为同分异构体且满足以下条件的有机物结构简式_________。
① 能与FeCl3溶液发生显色反应
② 能发生银镜反应
③ 核磁共振氢谱显示有5组峰
(6)请设计合理方案用![]() 合成
合成![]() 。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用口罩一般都是多层结构(如图所示),其液体原料主要是聚丙烯(Polypropylene,简称PP)。生成聚丙烯的单体是丙烯。下列说法中正确的是( )
A.丙烯分子中最多有9个原子共平面
B.聚丙烯材料难溶于水,也没有固定的熔点
C.丙烯生成聚丙烯的方程式为nCH3CH=CH2 ![]()
![]()
D.医用一次性口罩使用后应投入“可回收垃圾箱”回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,大量排放烟气形成酸雨、污染大气,因此对烟气进行脱硫、脱硝,对环境保护有重要意义。回答下列问题:
Ⅰ.利用CO脱硫
(1)工业生产可利用CO气体从燃煤烟气中脱硫,则25℃时CO从燃煤烟气中脱硫的热化学方程式2CO(g)+SO2(g)2CO2(g)+S(s)的焓变△H=_____________。25℃,100kPa时,由元素最稳定的单质生成1mol纯化合物时的反应热称为标准摩尔生成焓,已知一些物质的“标准摩尔生成焓”如下表所示:
物质 | CO(g) | CO2(g) | SO2(g) |
标准摩尔生成焓fHm(25℃)/kJmol-1 | -110.5 | -393.5 | -296.8 |
(2)在模拟脱硫的实验中,向多个相同的体积恒为2L的密闭容器中分别通入2.2mol CO和1mol SO2气体,在不同条件下进行反应,体系总压强随时间的变化如图所示。
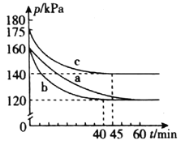
①在实验b中,40 min达到平衡,则0~40 min用SO2表示的平均反应速率v(SO2)=_______。
②与实验a相比,实验b可能改变的条件为_______________,实验c可能改变的条件为_________________。
Ⅱ.利用NH3脱硝
(3)在一定条件下,用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H=-1807.98kJ·mol-1。在刚性容器中,NH3与NO的物质的量之比分别为X、Y、Z(其中X<Y<Z),在不同温度条件下,得到NO脱除率(即NO转化率)曲线如图所示。
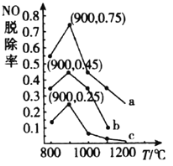
①NH3与NO的物质的量之比为X时对应的曲线为_____________(填“a”“b”或“c”)。
②各曲线中NO脱除率均先升高后降低的原因为__________。
③900℃条件下,设Z=![]() ,初始压强p0,则4NH3(g)+6NO(g)5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
,初始压强p0,则4NH3(g)+6NO(g)5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
Ⅲ.利用NaCIO2脱硫脱硝
(4)利用NaClO2的碱性溶液可吸收SO2和NO2(物质的量之比为1:1)的混合气体,自身转化为NaCl,则反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,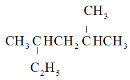 的名称为2,4-二甲基己烷
的名称为2,4-二甲基己烷
B.等质量的甲醇、甲醛完全燃烧时的耗氧量后者更多
C.将甲醇、乙醇和浓硫酸混合加热,最多得到3种有机产物
D.向丙烯醛(![]() )中滴入溴水,若颜色褪去就能证明结构中存在碳碳双键
)中滴入溴水,若颜色褪去就能证明结构中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法不正确的是
A.该反应为放热反应
B.容器I达到平衡所需要的时间比容器Ⅲ短
C.达到平衡时,容器I中的CH3OH体积分数大于容器Ⅱ
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com