
【题目】水蒸汽催化重整生物油是未来工业化制氢的可行方案。以乙酸为模型物进行研究,发生的主要反应如下:
Ⅰ.CH3COOH(g)+2H2O(g)2CO2(g)+4H2(g) △H1
Ⅱ.CH3COOH(g)2CO(g)+2H2(g) △H2
Ⅲ.CO2(g)+H2(g)CO(g)+H2O(g) △H3
回答下列问题:
(1)用△H1、△H2表示,△H3=___。
(2)重整反应的含碳产物产率、H2产率随温度、水与乙酸投料比(S/C)的变化关系如图(a)、(b)所示。

①由图(a)可知,制备H2最佳的温度约为___。
②由图(b)可知,H2产率随S/C增大而___(填“增大”或“减小”)。
(3)向恒容密闭容器中充入等物质的量的CH3COOH和H2O混合气体,若仅发生反应Ⅰ至平衡状态,测得H2的体积分数为50%,则CH3COOH的平衡转化率为___。
(4)反应体系常生成积碳。当温度一定时,随着S/C增加,积碳量逐渐减小,其原因用化学方程式表示为___。
【答案】![]() 800℃ 增大 40% C(s)+H2O(g)
800℃ 增大 40% C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
【解析】
(1)根据题干信息分析,反应Ⅲ=![]() (反应Ⅱ-反应Ⅰ),由盖斯定律可得
(反应Ⅱ-反应Ⅰ),由盖斯定律可得![]() ,故答案为:
,故答案为:![]() ;
;
(2)①由图(a)可知,制备H2在800℃时,达到最高转化率,则制备氢气最佳的温度约为800℃,故答案为:800℃;
②由图(b)可知,S/C增大时,反应I平衡向正反应方向移动,反应III平衡向逆反应方向移动,使体系中的H2的量增大,故答案为:增大;
(3)设CH3COOH和H2O的物质的量均为1mol,平衡时,反应了CH3COOH x mol,列三段式有:

测得H2的体积分数为50%,则![]() ,计算得x=0.4mol,醋酸的转化率为:
,计算得x=0.4mol,醋酸的转化率为:![]() =40%,即CH3COOH平衡转化率为40%,故答案为:40%;
=40%,即CH3COOH平衡转化率为40%,故答案为:40%;
(4)当温度一定时,随着S/C增加,积碳量逐渐减小,是由于积碳与水蒸气反应生成了CO和H2,反应的化学方程式为C(s)+H2O(g)![]() CO(g)+H2(g),故答案为:C(s)+H2O(g)
CO(g)+H2(g),故答案为:C(s)+H2O(g)![]() CO(g)+H2(g);
CO(g)+H2(g);


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】硝酸工业中产生的NO是一种大气污染物,可以通过如下反应处理:2NO(g)+2CO(g) ![]() N2 (g)+ 2CO2(g); △H1。
N2 (g)+ 2CO2(g); △H1。
(1)已知:2CO(g)+O2(g)=2CO2(g);△H2=-566 kJ·mol-l,N2(g)+O2(g) ![]() 2NO(g); △H3=+181 kJ ·mol-l,则△H1=___________
2NO(g); △H3=+181 kJ ·mol-l,则△H1=___________
(2)在一定温度下,向体积为2L的密闭容器中充入4 moI NO、2 mol CO。
①若为恒容密闭容器,在10min时达到平衡状态,压强为原来的14/15,这段时间内,NO的平均反应速率为___________,平衡常数为___________L· mol-1,此时NO的转化率a%;平衡后,向恒容密闭容器中再充入2 mol NO、1 mol CO,重新达到平衡时,NO的转化率将___________(填“增大”、“不变”或“减小”);
②若为恒压密闭容器,平衡后NO的转化率为b%,则a%________b%(填“<”、“=”或>”)
(3)工业上,NO与CO混合气体以一定流速和一定的比例,通过填充有A、B催化剂的反应器,在A、B两种催化剂作用下,CO转化率与温度的关系如下图所示。
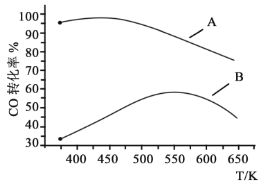
①工业上选择催化剂___________(填“A”或“B),理由是___________。
②在催化剂B作用下,高于550K时,CO转化率下降的理由可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】于固定体积的密闭容器中进行的气体反应A(g)+B(g) ![]() C(s)+2D(g),可以说明在恒温下已达到平衡状态的是
C(s)+2D(g),可以说明在恒温下已达到平衡状态的是
①反应容器中压强不随时间变化而变化 ②A气体和B气体的生成速率相等 ③混合气体的平均摩尔质量不随时间变化而变化 ④反应混合气体的密度不随时间变化而变化
A. ③④B. ②③C. ①③D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:
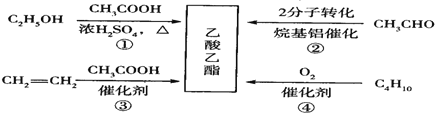
下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:
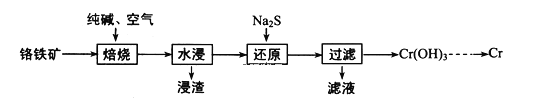
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___。
②浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则“还原”操作中发生反应的离子方程式为___。
(2)已知25℃时Cr3+恰好完全沉淀时溶液pH为5,(Cr3+浓度降至10-5molL-1可认为完全沉淀)则Cr(OH)3的溶度积常数Ksp=___。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+![]() Cr2O72-+H2O)。
Cr2O72-+H2O)。
①电极b连接电源的__极(填“正”或“负”),b极发生的电极反应:___。
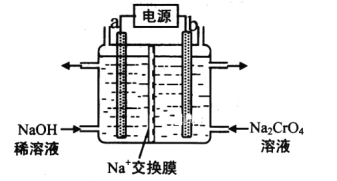
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则理论上生成重铬酸钠的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是
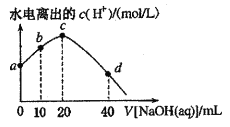
A. a点溶液中:c(H+)=6.0![]() 10-3mol
10-3mol![]() L-1
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是
A. 电解熔融NaCl制取金属钠的反应中,钠离子被还原,氯离子被氧化
B. 湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C. 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e
D. 铝热法还原铁的反应中,放出的热量能使铁熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据),根据下图回答下列问题:
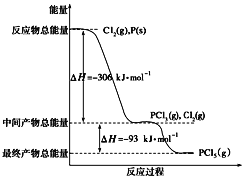
(1)PCl5分解生成PCl3和Cl2的热化学方程式__________________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8 mol PCl5,反应达到平衡时还剩余0.6 mol PCl5,其分解率α1等于____________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2____________α1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是______________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能 | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6(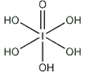 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为_____,孤电子对对数为______, I3-离子的空间构型为___________。
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。 A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(7)下图为碘晶体晶胞结构。有关说法中正确的是_____________。
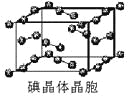
A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(8)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
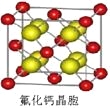
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com