
| A. | 工业上常利用电解熔融MgCl2冶炼金属镁 | |
| B. | 工业上可用NaBr溶液除去溴中含有的少量Cl2 | |
| C. | 富集溴元素过程中,空气吹出法利用了溴易挥发的性质 | |
| D. | 若提取1 mol Br2,至少需要标准状况下22.4 L的Cl2 |
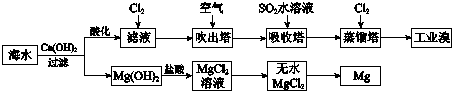
分析 依据流程分析,海水中加入氢氧化钙沉淀镁离子生成氢氧化镁沉淀,过滤后在沉淀中加入盐酸溶解,得到氯化镁溶液,通过浓缩蒸发,冷却结晶得到氯化镁晶体,在氯化氢气流中加热失水得到无水氯化镁,电解熔融氯化镁得到金属镁;海水浓缩晒盐得到卤水中通入氧化剂氯气氧化溴离子得到溴单质,2Br-+C12=Br2+2Cl-,吹入热的空气用二氧化硫吸收富集溴SO2+Br2+2H2O=4H++2Br-+SO42-,通入氯气发生氧化还原反应生成单质溴.
A.电解熔融MgCl2生成镁和氯气;
B.溴化钠溶液能和氯气反应,而被除去;
C.先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的;
D.依据离子方程式计算得到需要的氯气体积.
解答 解:A.从MgCl2溶液中得到MgCl2固体,电解熔融氯化镁得到金属镁和氯气,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;\;△\;\;}}{\;}$Mg+Cl2↑,故A正确;
B.工业溴中含少量Cl2,用溴化钠溶液除去,反应的化学方程式为:Cl2+NaBr=+NaCl+Br2,溴被除去,故B正确;
C.海水提取溴一般用氯气置换溴离子转化为溴单质,用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的,故C正确;
D.若提取1 mol Br2,依据2Br-+Cl2=Br2+2Cl-,提取粗溴消耗氯气物质的量为:1mol,得到纯溴需氯气物质的量为:1mol,所以在标准状况下体积为V=nVm=2mol×224.4L/mol=44.8 L,故D错误;
故选D.
点评 本题考查了海水资源的综合应用,为高频考点,涉及物质的分离提纯等知识,侧重于化学与生活的综合运用,培养了学生运用知识分析问题的能力,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | HCl、Na2CO3 | B. | AlCl3、NaOH | C. | NaAlO2、HCl | D. | MgCl2、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是一熵减反应 | |
| B. | 升高温度时,反应向逆方向进行 | |
| C. | 反应平衡时,v (CO2):v (CO)=1:2 | |
| D. | 充入N2使体系压强增大,能提高反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由红色变为深红色 | B. | 由无色变为深红色 | ||
| C. | 由浅红色变成深红色 | D. | 由无色变为浅红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. (并用单线桥标出电子转移的方向和数目).
(并用单线桥标出电子转移的方向和数目).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| B. | 制造新版人民币所使用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| C. | 为了增强漂白粉的使用效果,在使用漂白粉时必须和盐酸混合使用 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,该过程对青蒿素的提取属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装置漏气 | |
| B. | 镁带称量后擦去表面氧化膜 | |
| C. | 测定时氢气的实际温度高于记录温度数值 | |
| D. | 镁带中含有不溶于酸的杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com