
 Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如
Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如 下图所示:
下图所示:
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
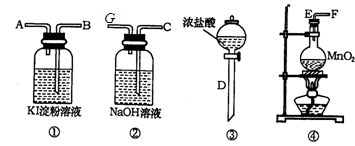
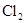 的反应方程式:______ 。
的反应方程式:______ 。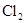 得到的
得到的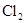 总小于
总小于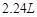 (标况下)为什么?___________________
(标况下)为什么?___________________  溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______ .
溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______ . 制备漂白粉,请写制备漂白粉的离子反应方程式:
制备漂白粉,请写制备漂白粉的离子反应方程式:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
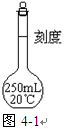
 ol·L-1的NaOH溶液,配制时:
ol·L-1的NaOH溶液,配制时: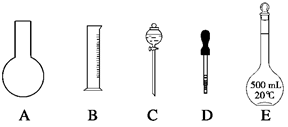
| A.加水定容时超过刻度线,又吸出少量水至刻度线 |
| B.忘记将洗涤液转入容量瓶 |
C.容量瓶洗涤后内壁有水珠而未作干燥处理 |
| D.溶液未冷却即转入容量瓶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 ______(填序号),还缺少的仪器有 。
______(填序号),还缺少的仪器有 。| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.用托盘天平准确称取所需的Na2CO3?10H2O晶体的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 的实验并回答相关问题。
的实验并回答相关问题。 除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。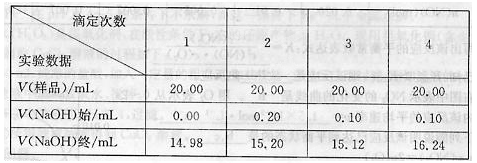
 要原因是 (填写序号)
要原因是 (填写序号) 吸取待测液
吸取待测液查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液 |
| B.除去苯中的少量苯酚:加入浓溴水振荡、静置后过滤,除去三溴苯酚沉淀 |
C.除去硝基苯中的硝酸:加入氢氧化钠溶液,振荡静置后 分液 分液 |
| D.1mol/L CuSO4溶液2mL和0.5mol/L NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀的颜色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.用滤纸称量NaO H固体 H固体 | B.未洗涤烧杯和玻璃棒 |
| C.容量瓶中原来含有少量蒸馏水 | D.定容时俯视刻度线观察液面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com