
| 实验序号 | 实验步骤 |
| ① | 向新制的Na2S溶液中滴加新制的氯水 |
| ② | 将镁条投入1mol/L的稀盐酸中 |
| ③ | 将铝条投入1mol/L的稀盐酸中 |
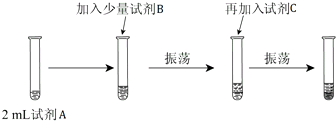
分析 【实验一】(1)由实验步骤可知,比较Mg、Al的金属性强弱,S、Cl的非金属性强弱,实验目的是性质(或金属性与非金属性)的递变规律;
(2)氯水与硫化钠反应生成S与NaCl,S为淡黄色且不溶;
【实验二】根据同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性来设计实验,要想比较氯气的氧化性大于溴的氧化性,只要使氯气和溴的盐溶液混合观察是否有溴单质生成,如果有溴单质生成就说明氯气的氧化性大于溴单质,否则不能证明.
解答 解:【实验一】(1)由实验步骤可知,实验序号①比较S、Cl的非金属性强弱,实验序号②③,比较Mg、Al的金属性强弱,所以实验目的是性质(或金属性与非金属性)的递变规律,
故答案为:性质(或金属性与非金属性)的递变规律;
(2)氯水与硫化钠反应生成S与NaCl,反应方程式为:Cl2+Na2S=S↓+2NaCl,现象:生成浅黄色沉淀,
故答案为:生成浅黄色沉淀;Cl2+Na2S=S↓+2NaCl;
【实验二】(3)要想比较氯气和溴单质的氧化性大小,做如下实验:
试剂A,取少量溴化钠反应( )→加适量氯水(振荡,溶液由黄绿色变成橙色)→加入四氯化碳(振荡)→现象(溶液分层,下层橙红色,上层无色)→说明氯气和溴离子反应,能证明氯气的氧化性大于溴.
故答案为:NaBr溶液;氯水;四氯化碳;
(4)溴单质在四氯化碳中的溶解度大于在水中的溶解度,水和四氯化碳是互不相溶的,所以试剂C在实验中所起的作用是萃取生成的溴,使现象更明显,加入C振荡、静置后看到的现象是:液体分成两层,上层接近无色、下层为橙色;氯气能将溴单质置换出来,氯气的氧化性大于溴,离子方程式为:Cl2+2Br-=Br2+2Cl-.
故答案为:萃取生成的溴,使现象更明显;液体分成两层,上层接近无色、下层为橙色,强于 Cl2+2Br-=2Cl-+Br2.
点评 本题考查化学实验方案、元素周期律,是一道同周期元素性质的递变规律的探究题,明确实验目的、正确选取实验药品、能根据实验现象得出结论是解本题的关键,培养了学生分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:填空题
| 混合溶液/实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
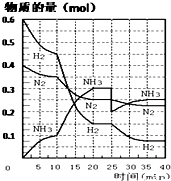
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
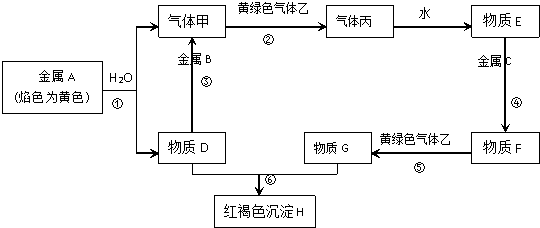
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
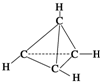 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )| A. | 2 种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | CO2通入苯酚钠溶液:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
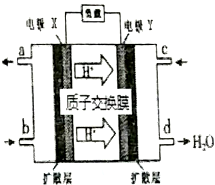
| A. | 氧气应从c处通入,电极Y上发生的反应为:O2+4e-+2H2O═4OH- | |
| B. | 电池在放电过程中,电极X周围溶液的pH增大 | |
| C. | 当该电池向外电路提供2 mol电子时消耗O2约为11.2L | |
| D. | 二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O-12e-+3H2O═2CO2+12H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com