
(16分)(一)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,通过测定褪色所需时间来判断反应的快慢。限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L 酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。该小组设计了如下的方案。
物理量 |
| H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/ mol·L-1 | 体积/mL | 浓度/ mol·L-1 | 体积/mL | ||
① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ |
|
|
| 0.010 | 4.0 | 25 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n (KMnO4) ≥_______。
(2)请完成表格内五处空白。
(3)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=______________ mol·L-1·min-1。
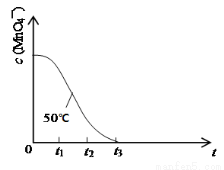
(4)已知50℃时c(MnO4—)~反应时间t的变化曲线如下图。其中反应速率最快的阶段是_____,原因是 。
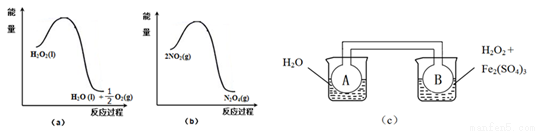
(二)利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________。
(一)(1)2:5或2.5;(2)
物理量 | 蒸馏水 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
体积/mL | 浓度/ mol·L-1 | 体积/mL | 浓度/ mol·L-1 | 体积/mL | ||
① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 1.0 | 0.20 | 1.0 | 0.010 | 4.0 | 25 |
(3)0.010或1.0×10-2;
(4)t1-t2, 随着反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑
的进行研究,产生的MnSO4作为反应的催化剂使反应速率加快。
(二)根据图(a)可知,H2O2分解放热,使得B瓶中温度升高,据图(b)可知,2NO2(g) N2O4(g)为放热反应,温度升高,平衡逆向移动,从而使NO2浓度增大,颜色加深。
N2O4(g)为放热反应,温度升高,平衡逆向移动,从而使NO2浓度增大,颜色加深。
【解析】
试题分析:(一)(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写者 出反应的化学方程式为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;为了观察到紫色褪去,高锰酸钾的物质的量应该少量,即c(H2C2O4):c(KMnO4)≥5:2=2.5,
故答案为:2:5或2.5;
(2)①和②除了温度不同,其他条件完全相同,是探究温度对化学反应速率影响;题干中只提供一种浓度的草酸,则只能在溶液总体积相等的情况下用蒸馏水将其调节成不同浓度,则设计五个空格的答案为:
物理量 | 蒸馏水 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
体积/mL | 浓度/ mol·L-1 | 体积/mL | 浓度/ mol·L-1 | 体积/mL | ||
① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 1.0 | 0.20 | 1.0 | 0.010 | 4.0 | 25 |
(3)草酸的物质的量为:0.10mol?L-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010mol?L-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为: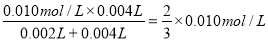 ,这段时间内平均反应速率v(KMnO4)=
,这段时间内平均反应速率v(KMnO4)=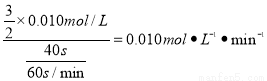 ,故答案为:0.010或1.0×10-2;
,故答案为:0.010或1.0×10-2;
(4)根据图中可知在o-t1,t1-t2,t2-t3,三段中c(KMnO4)的变化最大的是t1-t2, 故反应速率最快的阶段是t1-t2,原因是:随着反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑的进行研究,产生的MnSO4作为反应的催化剂使反应速率加快。
(二)(2)由图(a)可得热化学方程式H2O2(l)= H2O(l)+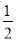 O2(g) ΔH<0,2NO2(g)
O2(g) ΔH<0,2NO2(g) N2O4(g) ΔH<0。由于H2O2的分解反应为放热反应[注意Fe2(SO4)3作催化剂],故右边烧杯中液体温度高于左边烧杯中液体温度,则B瓶中气体的温度高于A瓶中气体的温度,升高温度,2NO2(g)
N2O4(g) ΔH<0。由于H2O2的分解反应为放热反应[注意Fe2(SO4)3作催化剂],故右边烧杯中液体温度高于左边烧杯中液体温度,则B瓶中气体的温度高于A瓶中气体的温度,升高温度,2NO2(g)  N2O4(g) 的平衡逆向移动,c(NO2)增大,混合气体颜色加深。故答案为:深 据图(a)可知,H2O2分解放热,使得B瓶中温度升高,据图(b)可知,2NO2(g)
N2O4(g) 的平衡逆向移动,c(NO2)增大,混合气体颜色加深。故答案为:深 据图(a)可知,H2O2分解放热,使得B瓶中温度升高,据图(b)可知,2NO2(g) N2O4(g)为放热反应,温度升高,平衡逆向移动,从而使NO2浓度增大,颜色加深。
N2O4(g)为放热反应,温度升高,平衡逆向移动,从而使NO2浓度增大,颜色加深。
考点:考查化学反应速率和化学平衡的影响因素。


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源:2014秋广东省高二上学期期中考试(理)化学试卷(解析版) 题型:选择题
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后加入适量碘并封管,置于加热炉中,发生反应:  。下列说法正确的是
。下列说法正确的是

A.在不同温度区域,TaI4 的量保持不变
B.在提纯过程中,I2 的量不断减少
C.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
D.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
查看答案和解析>>
科目:高中化学 来源:2014秋广东省高二上学期期中考试(文)化学试卷(解析版) 题型:选择题
铝不易被腐蚀,其主要原因是
A.铝是一种轻金属
B.铝的金属活动性比镁弱
C.铝具有较高熔点
D.铝易形成致密的氧化物薄膜
查看答案和解析>>
科目:高中化学 来源:2014秋广东省高二上学期期中考试(文)化学试卷(解析版) 题型:选择题
当光束通过下列分散系时,能观察到丁达尔效应的是
A.Fe(OH)3胶体 B.盐酸
C.NaCl溶液 D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源:2014秋广东省广州市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g),ΔH<0。某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g),ΔH<0。某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
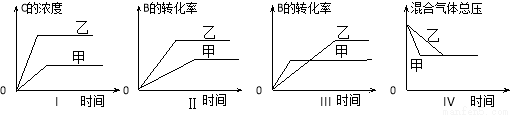

下列判断正确的是
A.图I研究的是温度对反应的影响,且乙的温度较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图III研究的是温度对反应的影响,且乙的温度较低
D.图IV研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
查看答案和解析>>
科目:高中化学 来源:2014秋广东省广州市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
下列叙述正确的是
A.SO2是电解质,其水溶液能导电
B.酸式盐的水溶液一定呈酸性
C.常温时水电离出的c(H+)=10-4 mol/L的溶液,不可能是稀盐酸
D.常温时纯水的电离平衡常数为1.0×10-14
查看答案和解析>>
科目:高中化学 来源:2014秋广东省广州市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
糖类、油脂和蛋白质的共同特点是
A.均是高分子化合物
B.常温下,遇碘水均会显蓝色
C.均只含有C、H、O三种元素
D.均是生命活动必不可少的物质
查看答案和解析>>
科目:高中化学 来源:2014秋广东省广州市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
化学与生活息息相关。下列叙述正确的是
A.鲜榨橙汁遇到碘水会变蓝
B.馒头越嚼越甜
C.油脂经水解可变成葡萄糖
D.土豆中的淀粉经水解可变成酒(乙醇)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com