
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
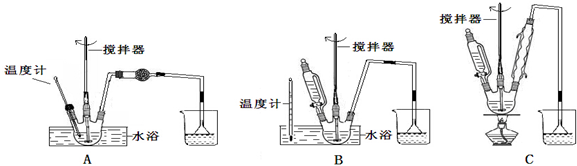
分析 (1)由于实验中需要能够控制滴加溴和水浴加热;由于葡萄糖是一种多羟基的醛,所以可以被弱氧化剂氧化成羧酸类,通过醛类催化氧化是最合适的;
(2)增加某一种物质的量,可以提高另一种物质的转化率;符合强酸制备弱酸原理,氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙;
(3)根据表格中葡萄糖酸钙的溶解度与温度的关系解答;
(4)葡萄糖酸钙在乙醇中的溶解度是微溶,有利于葡萄糖酸钙的析出;
(5)利用水可以将无机杂质溶解除掉,同时利用葡萄糖酸钙在乙醇中的微溶,减少葡萄糖酸钙的损失.
解答 解:(1)由于实验中需要能够控制滴加溴和水浴加热,A不能控制添加溴,C没有进行水浴加热,故装置B最合适,由于葡萄糖是一种多羟基的醛,所以可以被弱氧化剂氧化成羧酸类,酸性高锰酸钾溶液可以氧化羟基,A、D会产生重金属杂质离子,通过醛类催化氧化是最合适的,
故答案为:B;C;
(2)第②步充分反应后CaCO3固体需有剩余,其目的是:提高葡萄糖酸的转化率,符合强酸制备弱酸原理,氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙,不宜用CaCl2替代CaCO3,
故答案为:提高葡萄糖酸的转化率;氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙;
(3)温度高时,葡萄糖酸钙的溶解度较大,趁热过滤,可避免葡萄糖酸钙的损失,
故答案为:防止葡萄糖酸钙冷却结晶析出;
(4)葡萄糖酸钙在乙醇中的溶解度是微溶,可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙的析出,
故答案为:可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙的析出;
(5)洗涤沉淀,应避免沉淀溶解,且能将沉淀吸附物冲洗去,可用乙醇-水混合溶液,如只用水,则造成葡萄糖酸钙溶解而损失,只用乙醇,不能将杂质全被洗去,
故答案为:C.
点评 本题考查制备方案的设计,题目难度中等,涉及对工艺流程的理解、对装置于操作的分析与评价、物质的量分离提纯等知识,操作考查学生对知识的迁移应用,题目体现化学再生活、生产中应用.


科目:高中化学 来源: 题型:选择题
| A. | 溶解、蒸发 | B. | 萃取、蒸馏 | C. | 分液、蒸馏 | D. | 萃取、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 把t2℃时的MgSO4饱和溶液的温度升高,溶液仍然饱和 | |
| B. | 将t3℃时的MgSO4饱和溶液的温度降低,有晶体析出 | |
| C. | t2℃时,饱和溶液的溶质物质的量浓度:MgSO4比NaCl大 | |
| D. | 分别将t1℃时MgSO4饱和溶液、NaCl饱和溶液的温度升高到t2℃,所得溶液的溶质质量分数前者更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{r(Ca)}{r(Mg)}$ | B. | $\frac{r(C{l}^{-})}{r(A{l}^{3+})}$ | C. | $\frac{r(Na)}{r(Mg)}$ | D. | $\frac{r(N{a}^{+})}{r({F}^{-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢是用量最大、用途最广的合金,根据其化学成分可分为高碳钢和低碳钢两大类 | |
| B. | 二氧化硫、二氧化氮是主要的大气污染物,它们能直接危害人体健康还能形成酸雨,酸雨的PH值通常小于6.5 | |
| C. | 多糖和蛋白质都是在生命活动中能起到重要作用的高分子化合物,它们的水解产物都属于烃的衍生物 | |
| D. | 合成高分子材料在现代生活中发挥着极大的作用,聚苯乙烯、酚醛树脂、涤纶、顺丁橡胶都是由单体缩聚形成的体型高分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水,浓H2SO4 | B. | 溴水,浓H2SO4 | ||
| C. | 无水硫酸铜,浓H2SO4 | D. | 浓H2SO4,酸性高锰酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com