
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
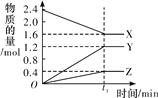
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
【答案】 2X![]() 3Y+Z(写“===”不得分) 36.8 kJ
3Y+Z(写“===”不得分) 36.8 kJ ![]() mol/(L·min) ABD
mol/(L·min) ABD
【解析】分析:(1)化学反应中,各物质的物质的量的变化值与化学计量数呈正比,以此书写化学方程式;
(2)利用转化的物质的量计算反应热,根据反应速率的含义计算;当反应中各物质的物质的量不再变化时,反应达到平衡状态,各物质的浓度不变,由此衍生的一些物理量不变。
详解:(1)由图象可以看出,X的物质的量逐渐减小,则X为反应物,Y、Z的物质的量逐渐增多,作为Y、Z为生成物,当反应到达t1min时,△n(X)=0.8mol,△n(Y)=1.2mol,△n(Z)=0.4mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(X):△n(Y):△n(Z)=2:3:1,所以反应的化学方程式为2X![]() 3Y+Z;
3Y+Z;
(2)由于1mol氨气分解成氮气和氢气要吸收46kJ的热量,而反应中△n(X)=0.8mol,热效应为:0.8mol×46kJ/mol=36.8kJ;在此t1 min时间内生成氢气是1.2mol,浓度是0.6mol/L,则用H2表示该反应的平均速率v(H2)为![]() mol/(L·min);
mol/(L·min);
A.容器内各气体组分的质量分数不再发生改变说明正逆反应速率相等,反应达到平衡状态,A正确;
B.正反应速率与逆反应速率相等,反应达到平衡状态,B正确;
C.由于反应在体积不变的密闭容器中进行,反应过程中气体的体积不变,质量不变,则混合气体的密度不变,不能判断是否达到平衡状态,C错误;
D.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以混合气体的平均相对分子质量不再发生改变,反应达到平衡状态,D正确;答案选ABD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高铁酸盐(如Na2FeO4)已经被广泛应用在水处理方面,以铁基材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,装置如图。下列说法不正确的是

A. a为阳极,电极反应式为Fe—6e- +8OH- =FeO42- +4H2O
B. 为防止高铁酸根扩散被还原,则离子交换膜为阳离子交换膜
C. 在电解过程中溶液中的阳离子向a 极移动
D. 铁电极上有少量气体产生原因可能是4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃(只含有1个双键)与H2加成后的产物是CH3CHCH3CHCH3C(CH3)3,则该烯烃的结构式可能有
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为__________。
(2)⑨在元素周期表中的位置是_______________________________。
(3)用电子式表示④与⑦的原子形成化合物的过程:_________________________________。
(4)可以用来验证④⑤两种元素金属性强弱的实验是__________(填字母代号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入水中
b.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
c.将形状、大小相同的这两种元素的单质分别和温度相同的热水作用,并滴入酚酞
d.比较这两种元素的氢化物的稳定性
(5)⑥⑦两种元素的简单阴离子还原性较强的是________(填离子符号);用一个置换反应证实这一结论__________________________(填化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。
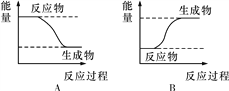
(1)若E1>E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图________(填“A”或“B”)表示。
(2)若E1<E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图________(填“A”或“B”)表示。
(3)太阳能的开发和利用是21世纪的一个重要课题。
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节。已知下列数据:
盐 | 熔点/℃ | 熔化吸热/kJ·mol-1 | 参考价格/元·kg-1 |
CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
Na2HPO4·12H2O | 36.1 | 100.1 | 1 600~2 000 |
Na2S2O3·5H2O | 48.5 | 49.7 | 1 400~1 800 |
其中最适宜作储能介质的是________(填字母代号)。
A.CaCl2·6H2O B.Na2SO4·10H2O
C.Na2HPO4·12H2O D.Na2S2O3·5H2O
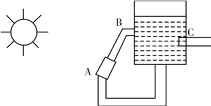
②下图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器。根据对水的密度的认识,你估计在阳光照射下水将沿________(填“顺”或“逆”)时针方向流动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾在不同的条件下发生的反应如下:
MnO4﹣+5e﹣+8H+═Mn2++4H2O①
MnO4﹣+3e﹣+2H2O═MnO2↓+4OH﹣②
MnO4﹣+e﹣═MnO42﹣(溶液绿色)③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的影响.
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为→ .
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的是(填字母).
A.氧化性:PbO2>KMnO4
B.Mn2+被还原成MnO4﹣
C.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3:2.完成下列化学方程式:
①KMnO4+K2S+═K2MnO4+K2SO4+S↓+ .
②若生成6.4g单质硫,反应过程中转移电子的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学反应方程式的书写及反应类型判断都正确的是
A. CH3CH2OH +Na→CH3CH2ONa + H2↑ 置换反应
B. CH2=CH2+Br2→CH2BrCH2Br 加成反应
C. ![]() 氧化反应
氧化反应
D. C2H6+Cl2 →C2H4Cl2+H2 取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
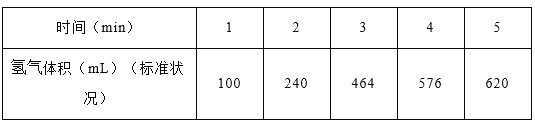
①哪一时间段反应速率最大______min(填0~1、1~2、2~3、3~4、4~5),原因是_____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是____。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
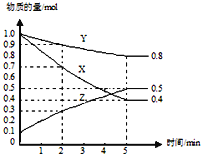
①该反应的化学方程式是_______。
②该反应达到平衡状态的标志是______
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1mol Y的同时消耗2mol Z
③2min内Y的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度盐酸滴定未知浓度的NaOH溶液,以酚酞作指示剂,下列操作会使所测NaOH溶液浓度偏低的是( )
A.锥形瓶洗净后还留有蒸馏水
B.取碱液的滴定管开始有气泡,放出液体后气泡消失
C.溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液无变化
D.用碱式滴定管取一定体积的NaOH溶液时,量取前仰视读数,量取后俯视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com