
| A. | 将SO2通入含HClO的溶液中生成H2SO4 HClO的酸性比H2SO4强 | |
| B. | 铝箔在酒精灯火焰上加热熔化但不滴落 铝箔表面氧化铝熔点高于铝 | |
| C. | SiO2可以和碱溶液及酸溶液反应 SiO2属于两性氧化物 | |
| D. | 将SO2通入溴水中,溴水褪色 SO2具有漂白性 |
分析 A.发生氧化还原反应生成硫酸,不能比较酸性的强弱;
B.铝与氧气反应生成氧化铝的熔点高;
C.与酸或碱反应生成盐和水的氧化物,为两性氧化物;
D.发生氧化还原反应生成硫酸和HBr.
解答 解:A.发生氧化还原反应生成硫酸,不能比较酸性的强弱,不发生强酸制取弱酸的反应,事实上硫酸为强酸、HClO为弱酸,故A错误;
B.铝与氧气反应生成氧化铝的熔点高,则铝箔在酒精灯火焰上加热熔化但不滴落,故B正确;
C.与酸或碱反应生成盐和水的氧化物,为两性氧化物,而二氧化硅与盐酸、硫酸等不反应,只属于酸性氧化物,故C错误;
D.发生氧化还原反应生成硫酸和HBr,S元素的化合价升高,体现二氧化硫具有还原性,故D错误;
故选B.
点评 本题考查化学实验方案的评价,涉及氧化还原反应、酸性比较、二氧化硫和铝的化学性质等,注重物质性质及物质分类的考查,综合性较强,但题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能 (kJ/mol) | 414 | 615 | 347 | 435 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
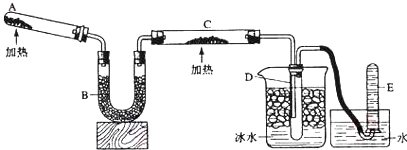
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炒菜时加入一些料酒和食醋,这样可使菜变得味香可口,这是因为有酯类物质生成 | |
| B. | 禁止使用工业酒精配制料酒,这是因为工业酒精中常含有少量会使人中毒的甲醇 | |
| C. | 苯酚不小心蘸到皮肤上,应用NaHCO3溶液擦洗 | |
| D. | 夏季蚊虫较多,一旦被叮咬,就会感到皮肤瘙痒,这是由于蚊虫的分泌液中含有甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
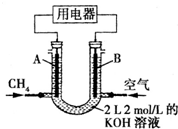 将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯中混有的少量硫酸和硝酸,将其倒入盛有NaOH溶液的分液漏斗中,振荡,静置,分液 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出碘 | |
| D. | 乙烯中混有SO2和CO2,将其通入溴水中洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解可获得乙烯、丙烯和丁二烯 | |
| B. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点 | |
| D. | 酚醛树脂、聚酯纤维(涤纶)都是由缩聚反应制得的高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com