
【题目】下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KC1O3+6HCl=3Cl2↑+KCl+3H2O
③KMnO4+HCl(浓)—KCl+MnCl2+Cl2↑+H2O(未配平)
根据以上三个反应,回答有关问题:
(1)反应的②的离子方程式为_________________________________________________________。
(2)反应②中,氧化产物与还原产物的质量比为____________________________。
(3)请将反应③配平:_____KMnO4+_____HCl(浓)=_____KCl+____MnCl2+_____Cl2↑+_____H2O
(4)若要制得相同质量的氯气,反应中电子转移的数目之比(①:②:③)为___________________。
(5)己知反应④:4HCl(g)+O2![]() 2Cl2+2H2O(g),该反应也能制得氯气,则 MnO2、O2、KMnO4。三种物质氧化性由强到弱的顺序为____________________________________________。
2Cl2+2H2O(g),该反应也能制得氯气,则 MnO2、O2、KMnO4。三种物质氧化性由强到弱的顺序为____________________________________________。
【答案】 ClO-+5Cl-+6H+=3Cl2↑+3H2O 5:1 2、16、2、2、5、8 6:5:6 KMnO4>MnO2>O2.
【解析】试题分析:(1)反应KClO3+6HCl═3Cl2↑+KCl+3H2O的离子方程式为:ClO3-+6H++5Cl-=3Cl2↑+3H2O;
(2)反应②中只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,氯气既是氧化产物又是还原产物,则氧化产物与还原产物的质量比为5:1;
(3)该反应中Mn元素化合价由+7价变为+2价、部分Cl元素化合价由-1价变为0价、部分Cl元素化合价不变,其转移电子总数为10,则KMnO4的系数为2,氯气系数为5,结合原子守恒配平方程式为:2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O;
(4)制取的氯气质量相等,则制取的氯气物质的量相等,假设制取的氯气都是1mol,
①中生成1mol氯气转移电子物质的量=1mol×2×[0-(-1)]=2mol;
②中生成1mol氯气转移电子物质的量=5mol/3=5/3mol;
③中生成1mol氯气转移电子物质的量=1mol×2=2mol;
则三个方程式中转移电子物质的量之比=2mol:5/3mol:2mol=6:5:6;
(5)根据方程式①4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O、
MnCl2+Cl2↑+2H2O、
③KMnO42KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O、
④4HCl(g)+O2![]() 2Cl2+2H2O,③没有反应条件,①的反应条件是加热,④的反应条件是加热和催化剂,反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强,所以氧化性最强的是高锰酸钾,其次是二氧化锰,最后是氧气。
2Cl2+2H2O,③没有反应条件,①的反应条件是加热,④的反应条件是加热和催化剂,反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强,所以氧化性最强的是高锰酸钾,其次是二氧化锰,最后是氧气。


科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知: Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。请回答下列问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_________。
(2)用于微电子器件生产的锡粉纯度测定(已知锡的相对原子质量为119): ①取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn 完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00mL。步骤②中加入Fe2(SO4)3的作用是________;此锡粉样品中锡的质量分数为_________。若在滴定终点时俯视读数,则会导致测得的样品中锡的质量分数________(填“偏高“偏低”或“无影响”)。
(2)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①步骤I加入Sn粉的作用:____________及调节溶液pH。
②步骤II用到的玻璃仪器有烧杯、____________。
③步骤III生成SnO的离子方程式: ____________。
④步骤IV中检验SnO是否洗涤干净的操作是____________,证明已洗净。
⑤步骤V操作依次为____________ 、____________过滤、洗涤、低温干燥。
(4)实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着卤族元素原子半径的增大,下列递变规律正确的是
A. 单质的熔、沸点逐渐降低 B. 卤素离子的还原性逐渐增强
C. 气态氢化物稳定性逐渐增强 D. 单质的氧化性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于0.1 mol·L-1 CH3COOH溶液说法正确的是( )
A. 加水稀释溶液中所有离子的浓度都减小
B. 加水稀释后溶液中 的比值减小
的比值减小
C. 加入少量氢氧化钠固体,溶液的pH增大
D. 加入少量盐酸,抑制醋酸的电离,故醋酸的电离平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
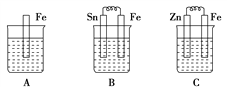
①B中Sn极的电极反应式为_______;Sn极附近溶液的pH(填“增大”、“减小”或“不变”)______。
②C中总反应离子方程式为_______________。
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:
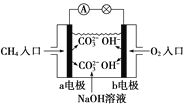
①电池的负极是________(填“a”或“b”)电极,该极的电极反应是:_______________________。
②常温下,如果该原电池电解质溶液为pH=13的氢氧化钠500mL,构成原电池一段时间后pH变为12,则构成原电池消耗了标准状况下__________ mL甲烷,(假设化学能全部转化为电能,忽略氢氧化钠溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的碳酸钠和氢氧化钠的固体混合物完全溶于水,制成180mL稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:(提示:假设V混=V1+V2)
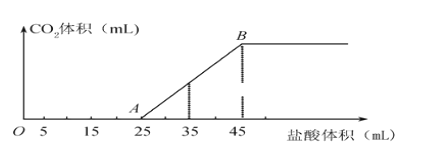
(1)写出OA段所发生反应的化学方程式_____________________,________________________。
(2)当加入35 mL盐酸时,产生CO2的体积为_______________________mL(标准状况)。
(3)原混合物中NaOH的质量为________g。
(4)B点时溶液中钠离子的物质的量浓度为_______________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示. 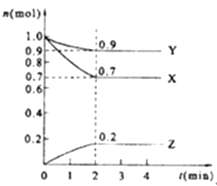
(1)由图中所给数据进行分析,该反应的化学方程式为;
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=;
(3)2min反应达平衡容器内混合气体的平均相对分子质量比起始时(填增大、减小或不变);混合气体密度比起始时(填增大、减小或不变).
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),则原混合气体中a:b= .
(5)下列措施能加快反应速率的是 .
A.恒压时充入He
B.恒容时充入He
C.恒容时充入X
D.及时分离出Z
E.升高温度
F.选择高效的催化剂
(6)下列说法正确的是 .
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率减慢.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物燃料电池中,以H2-CO混合气体为燃料,基本原理如图所示。下列说法不正确的是
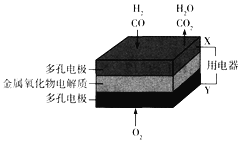
A. X极是原电池的负极,发生氧化反应
B. 负极的电极反应式为H2+O2--2e-===H2O、C O + O 2--2e-===CO2
C. Y极每消耗16gO2,电路中有2mol电子通过
D. 同温同压下两极消耗的气体体积之比是1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备,符合工业生产实际的是( )
A.将氯气通入澄清石灰水中制漂白粉
B.用离子交换膜法电解饱和食盐水制备烧碱、氢气和氯气
C.将氢气和氯气混合后点燃,产物用水吸收制备盐酸
D.将SO2和O2的混合气加高压后,通过接触室,制备SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com