
| A、该元素原子中,3d、4s电子的能量逐渐升高 |
| B、该元素位于周期表ds区 |
| C、该元素在元素周期表中的位置为第四周期IIIB族 |
| D、该元素原子最外层有3个电子 |


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定有Al3+、SO42-,可能有K+、NH4+ |
| B、肯定无Fe2+、Mg2+、CO32-,可能有Al3+ |
| C、原溶液一定是明矾和MgSO4的混合溶液 |
| D、不能确定的离子只能通过焰色反应来确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两粒子的1s能级上的电子能量相同 |
| B、两粒子的3p能级上的电子离核的距离相同 |
| C、两粒子的电子发生跃迁时,产生的光谱不同 |
| D、两粒子都达8电子稳定结构,化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
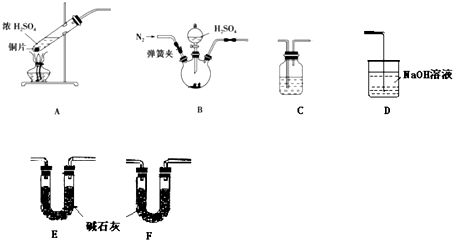
查看答案和解析>>
科目:高中化学 来源: 题型:
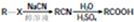
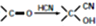
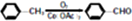
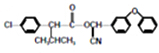 )
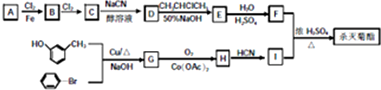
)
 注:合成路线的书写格式参照如下示例流程图:
注:合成路线的书写格式参照如下示例流程图:
查看答案和解析>>
科目:高中化学 来源: 题型:
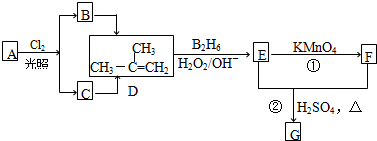
| ||
| H2O2/OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
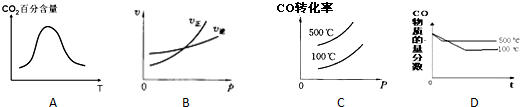
查看答案和解析>>
科目:高中化学 来源: 题型:
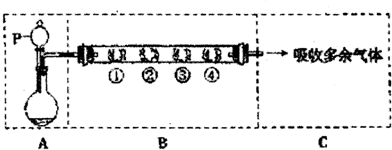
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所 蘸 试剂 | 石蕊试纸 | 品红溶液 | 淀粉和碘水混合物 | 氢硫酸 |
| 现象 | 褪色 | 浅黄色固体 | ||
| 体现SO2性质 | 水溶液显酸性 | 漂白性 | 氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com