
| A. | CH3-C≡CH和CH2=CH-CH=CH2 | B. | CH3-CH=CH2和 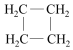 | ||
| C. | 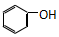 和 和 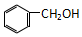 | D. | 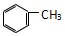 和 和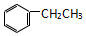 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的有机物虎为同系物,根据定义可知,互为同系物的有机物一定属于同一类物质,即官能团的种类和数目一定相同,据此分析.
解答 解:A、CH3-C≡CH是炔烃,CH2=CH-CH=CH2是二烯烃,两者结构不相似,故不是同系物,故A错误;
B、CH3-CH=CH2是烯烃,而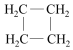 是环烷烃,两者结构不相似,故不是同系物,故B错误;
是环烷烃,两者结构不相似,故不是同系物,故B错误;
C、 是酚,而
是酚,而 是醇,两者属于不同种有机物,即结构不相似,故不是同系物,故C错误;
是醇,两者属于不同种有机物,即结构不相似,故不是同系物,故C错误;
D、 和
和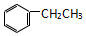 在结构中均只含一个苯环,且侧链均为烷烃基,故均属于苯的同系物,两者互为同系物,故D正确.
在结构中均只含一个苯环,且侧链均为烷烃基,故均属于苯的同系物,两者互为同系物,故D正确.
故选D.
点评 本题考查了同系物的概念和判断,应注意的是互为同系物的有机物的结构必须相似,即必须属于同一类物质,而且官能团的个数必须相同,且在分子组成上相差一个或若干个CH2原子团.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 31g白磷分子中所含p-p共价键数目为1.5NA | |
| B. | 标准状况下,2.24LD2中所含中子的数目是0.2NA | |
| C. | 常温常压下42g乙烯和丙烯的混合气体含氢原子数目为6 NA | |
| D. | 常温下,向1L0.2mol/L的盐酸溶液通入氨气,当溶液PH=7时,溶液中NH4+的数目小于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
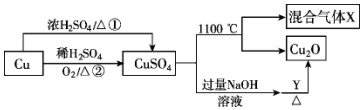
| A. | 相对于途径①,途径②更好地体现了绿色化学思想 | |
| B. | 硫酸铜在1100℃分解所得气体X可能是二氧化硫和三氧化硫的混合气体 | |
| C. | Y可以是葡萄糖溶液 | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶可制得胆矾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
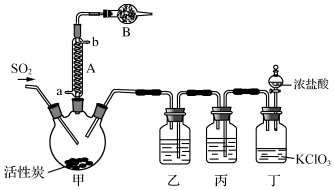
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.012kg12C所含的碳原子数就是阿伏伽德罗常数 | |
| B. | 等质量的O2和O3中所含氧原子的物质的量相同 | |
| C. | 等物质的量的分子所含原子数目一定相等 | |
| D. | 标准状况下,1molH2的体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com