
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1molN2时,转移的电子数为___mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。

反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。

【答案】![]() 迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大催化剂活性下降 NH3与O2反应生成了NO
迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大催化剂活性下降 NH3与O2反应生成了NO
【解析】
①NH3与NO2生成N2的反应方程式为8NH3+6NO2=7N2+12H2O,该反应中生成7molN2时,转移的电子的物质的量为24mol,据此计算生成1molN2时转移电子的物质的量;
②在一定温度范围内催化剂活性较大,超过温度范围,催化剂活性降低;在一定温度和催化剂存在的条件下,氨气能催化氧化能生成NO。
①NH3与NO2生成N2的反应方程式为8NH3+6NO2=7N2+12H2O,该反应中生成7molN2时,转移的电子的物质的量为24mol,因此生成1molN2时转移电子的物质的量为![]() ×1mol=
×1mol=![]() mol;
mol;
②在一定温度范围内催化剂活性较大,超过温度范围,催化剂活性降低,由图可知迅速上升段是催化剂活性随温度升高而增大,与温度升高共同使NOx的去除反应速率增大;上升阶段缓慢主要是温度升高引起的NOx的去除反应速率增大但催化剂活性降低;在一定温度和催化剂存在的条件下,氨气能催化氧化能生成NO,当温度高于380℃时,NOx的去除反应速率下降的原因可能是氨气在该条件下与氧气反应生成NO。


科目:高中化学 来源: 题型:
【题目】请补充完成下列方程式![]() 配平或按要求写方程式
配平或按要求写方程式![]()
(1)______NH3+_________O2=___________NO+____________H2O
(2)_____________NO2+____________NaOH=____________NaNO2+____________NaNO3+________H2O
(3)____________Fe(OH)3+____________OH-+____________Cl2=____________FeO42-+____________Cl-+____________H2O
(4)___________Cu(IO3)2+____________KI+____________H2SO4=____________CuI↓+____________I2+____________K2SO4+___________H2O
(5)_______MnO4-+_______C2O42-+_______=_______Mn2++_______CO2↑+______________
(6)NaAlH4是一种重要的还原剂,它与水发生氧化还原反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
(1)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___。
(2)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A. 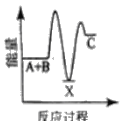 B.
B. 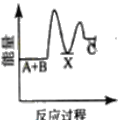
C. 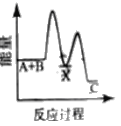 D.
D. 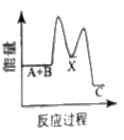
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+、K+、NH![]() 、Fe2+、Al3+、CO
、Fe2+、Al3+、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如图:
、Cl-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如图:

下列结论正确的是( )
A.X中肯定存在Na+、Fe2+、Al3+、NH![]() 、SO
、SO![]()
B.X中不能确定的离子是Al3+、Na+、K+和Cl-
C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH)3
D.气体F经催化氧化可直接生成气体D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验探究小组研究320K时![]() 的分解反应:
的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
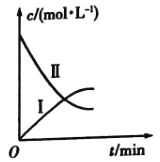
t/min | 0 | 1 | 2 | 3 | 4 |
| 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
| 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是![]() 的浓度变化曲线
的浓度变化曲线
B.曲线Ⅱ是![]() 的浓度变化曲线
的浓度变化曲线
C.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
D.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(△H),已知:
化学键 | H-H | Cl-Cl | H-Cl |
键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
则下列热化学方程式不正确的是___(把正确的一个选项填在横线上)
a.![]() H2(g)+
H2(g)+![]() Cl2(g)═HCl(g) △H=﹣91.5kJmol﹣1
Cl2(g)═HCl(g) △H=﹣91.5kJmol﹣1
b.H2(g)+Cl2(g)═2HCl(g) △H=﹣183kJmol﹣1
c.2HCl(g)═H2(g)+Cl2(g) △H=+183kJmol﹣1
d.![]() H2(g)+
H2(g)+![]() Cl2(g)═HCl(g) △H=+91.5kJmol﹣1
Cl2(g)═HCl(g) △H=+91.5kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应![]() 的能量变化如图所示:
的能量变化如图所示:
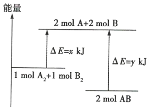
(1)2mol AB的总能量___________________(填“高于”或“低于”)1mol A2和1mol B2的总能量,该反应为___________(填“吸收”或“释放”)能量的反应。
(2)断裂2mol A2和2mol B2的化学键需吸收______kJ能量,断裂1.5mol AB的化学键需吸收_____kJ能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com