
| A. | 次氯酸分子的电子式: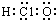 | B. | CH4Si的结构式: | ||
| C. | HCN分子的结构式:H-C≡N | D. | 丙烷分子的比例模型: |
分析 A.次氯酸中氧原子成两个共价键,O原子与Cl原子、H原子分别形成1对共用电子对;
B.CH4Si的结构与乙烯类似,C原子与Si原子之间形成2对共用电子对,为C=Si双键;
C.HCN分子中C原子核外有4个电子能形成4个共价键,N原子核外有5个电子能形成3个共价键,分子内含有-C≡N;
D.图为球棍模型,黑色球代表C原子.
解答 解:A.次氯酸中氧原子成两个共价键,O原子与Cl原子、H原子分别形成1对共用电子对,电子式为 ,故A错误;
,故A错误;
B.CH4Si的结构与乙烯类似,C原子与Si原子之间形成2对共用电子对,为C=Si双键,CH4Si的结构式为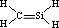 ,故B错误;
,故B错误;
C.HCN分子中C原子核外有4个电子能形成4个共价键,N原子核外有5个电子能形成3个共价键,分子内含有-C≡N,故C正确;
D.丙烷分子的球棍模型为 ,故D错误;
,故D错误;
故选:C.
点评 本题考查化学用语,涉及电子式、结构式、球棍模型、比例模型等,注意把握不同的化学用语并规范使用.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,比较S2-与Cl-的半径大小:r(S2-)>(填“>”或“<”)r(Cl-).
,比较S2-与Cl-的半径大小:r(S2-)>(填“>”或“<”)r(Cl-).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
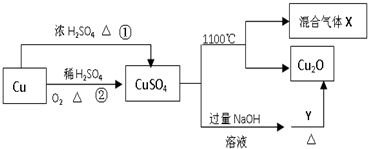
| A. | 途径①和途径②都体现了硫酸的酸性和氧化性 | |
| B. | 将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | Y可以是酒精溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 4-甲基-1-戊烯
4-甲基-1-戊烯 苯甲酸
苯甲酸




 B.
B. 与
与 C.
C. 与
与 D.
D. 与
与 E.
E. 与
与 F.2-甲基丁烷和2,2-二甲基丙烷.
F.2-甲基丁烷和2,2-二甲基丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com