
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
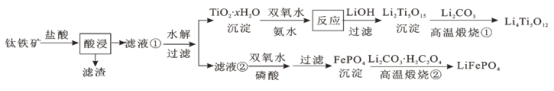
下列说法不正确的是
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl- = Fe2++ TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑
温度/ | 30 | 35 | 40 | 45 | 50 |
TiO2 ·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
D.TiO2 ·xH2O沉淀与双氧水、氨水反应40min所得实验结果如上表所示, 40 oC前,未达到平衡状态,随着温度升高,转化率变大
【答案】B
【解析】
利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备Li4Ti5O12和LiFePO4,根据制备流程可知加入盐酸过滤后滤渣为SiO2,滤液①中含有Mg2+、Fe2+、Ti4+,水解后过滤,沉淀为TiO2·xH2O,经过一系列转化为最终转化为Li4Ti5O12。滤液②中加入双氧水亚铁离子被氧化,在磷酸的作用下转化为磷酸铁,通过高温煅烧最终转化为LiFePO4,据此解答。
A. “酸浸”后,若钛主要以TiOCl42-形式存在,因此相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,A正确;
B. Li2Ti5O15中Ti的化合价为+4,Li的化合价是+1价,由化合价代数和为0可知,氧元素的负价代数和为22,设其中过氧键的数目为x个,则2x+(15-2x)×2=22,解得x=4,B错误;
C. 根据以上分析可知“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑,C正确;
2LiFePO4+H2O+3CO2↑,C正确;
D. 根据表中数据可知40oC时转化量最高,因低于40oC时TiO2·xH2O转化反应速率随温度升高而增加,超过40oC双氧水分解和氨气逸出导致TiO2·xH2O转化反应速率下降,D正确;
答案选B。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】铜冶金术以火法治为主,炼铜的副产品SO2多用于制硫酸和石背等化学产品。火法炼铜的工艺流程如下:

反应I:2Cu2S(s)+3O2(g)→2Cu2O(s)+2SO2(g)+768.2kJ
反应II:2Cu2O(s)+Cu2S(s)→6Cu(s)+SO2(g)-116.0kJ
(1)在反应Ⅱ中,每生成1mol SO2转移电子_______mol,反应Cu2S(s)+O2(g)→2Cu(s)+SO2(g)+Q的Q=_____kJ。
(2)理论上m1:m2=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应 2SO3(g)![]() 2SO2(g)+O2(g),将2 mol SO3通入2 L容积恒定的密闭容器中,若维持容器内温度不变,5 min末测得SO3的物质的量为0.8 mol。则下列说法正确的是
2SO2(g)+O2(g),将2 mol SO3通入2 L容积恒定的密闭容器中,若维持容器内温度不变,5 min末测得SO3的物质的量为0.8 mol。则下列说法正确的是
A.若某时刻消耗了1 molSO3同时生成了0.5molO2,则表明该反应达到了平衡状态
B.若起始时充入3 mol SO3,起始时SO3分解速率不变
C.0~5min,SO2的生成速率v(SO2)=0.12mol·L-1·min-1
D.达到平衡时,SO2和SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用酒精和84消毒液混合使用可能发生反应:4NaClO+CH3CH2OH![]() HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
A.含NA个ClO-的NaClO溶液中,Na+数目为NA
B.上述反应中,每生成1molNaCl,转移的电子数为8NA
C.100 g质量分数为46%的乙醇溶液中所含的氢原子数为6NA
D.标准状况下,2.24 L HCCl3含有的共用电子对的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是

A. 浓H2SO4B. NaOH溶液C. NaCl溶液D. Ca(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
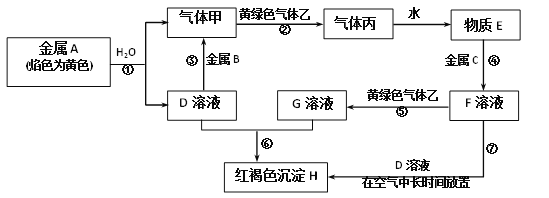
请根据以上信息完成下列各题:
(1)写出下列物质的化学式:B__________、丙__________。
(2)写出黄绿色气体乙的一种用途________________,反应过程⑦可能观察到的实验现象是_________________。
(3)写出反应①的化学方程式,并用单线桥法标出电子转移的方向和数目:______。
(4)反应③中的氧化剂是__________(写化学式,下同),反应④中的还原剂是________。
(5)写出反应⑤的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol · L-1NaOH溶液分别滴定20.00mL浓度均为0.1000 mol · L-1CH3COOH 溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是

A. 点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-)
B. 点③时:c(Na+)=c(CH3COO-)>c(H+)
C. 点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的组合是 ( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
【答案】C
【解析】A.铜粉与氯化铁反应生成氯化亚铁和氯化铜,会引入新杂质,故A错误;B.二者均与Fe反应,不符合除杂的原则,不能除杂,故B错误;C.Al与NaOH溶液反应,而Fe不能,则加NaOH溶解后过滤可除杂,故C正确;D.二者均与BaCl2溶液反应,应加适量硫酸除杂,故D错误;故选C。
【题型】单选题
【结束】
19
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
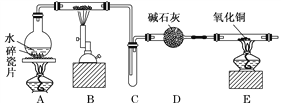
(1)A装置的作用是________________,B中反应的化学方程式为_____________。
(2)D的作用是____________________________________________________________。
(3)E中的现象是__________________________________________________________。
(4)A、B两个装置中应先点燃_______处的酒精灯,点燃E处酒精灯之前应进行的操作是_______________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com