
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.68 | 0.5 |
| ||
| △ |
| ||
| △ |
| ||
| 高温高压 |
| 32 |
| 2×13 |


科目:高中化学 来源: 题型:
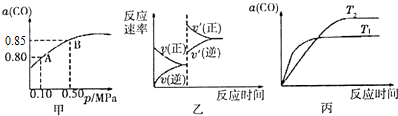
| A、由图甲知,A点CO的平衡浓度为0.4 mol?L-1 |
| B、由图甲知,B点CO、O2、CO2的平衡浓度之比为2:l:2 |
| C、达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D、若0.50 MPa时不同温度下CO转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
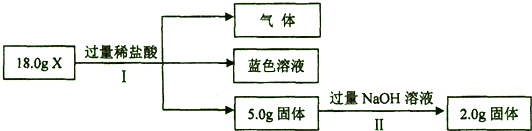
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 |
| B、0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液 |
| C、pH=4的醋酸溶液和pH=10的氢氧化钠溶液 |
| D、pH=4的盐酸和pH=9的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO3和HNO3 |
| B、Na2SO3和H2SO4 |
| C、Na2S和H2SO4 |
| D、Na2S和HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属Mg与稀硫酸和CO2均能反应,其反应类型相同 |
| B、FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 |
| C、SO2气体通入紫色石蕊试液中,溶液先变红后褪色 |
| D、氢氧化铝、碳酸铵、碳酸氢钠、甘氨酸都既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH4 | C2H2 | H2 | |
| 燃烧热/kJ/mo | 890.3 | 1299.6 | 285.8 |
| A、-C≡C-的键角为120° |
| B、2H2(g)+O2(g)-2H2O(g)△H=-571.6 kj?mol-l |
| C、C-H键键长小于H-H键 |
| D、2CH4(g)=C2H2(g)+3H2(g)△H=+376.4 kj?mol-l |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com