
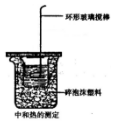
 ijĶ¬Ń§ÓĆČēĶ¼×°ÖĆ×öÖŠŗĶČČµÄ²ā¶ØŹµŃé
ijĶ¬Ń§ÓĆČēĶ¼×°ÖĆ×öÖŠŗĶČČµÄ²ā¶ØŹµŃé·ÖĪö £Ø1£©øł¾ŻĮæČČ¼ĘµÄ¹¹ŌģĄ“ÅŠ¶ĻøĆ×°ÖƵÄȱɣŅĒĘ÷£»
£Ø2£©¢ŁĪ“¼°Ź±²ā³ö×īøßĪĀ¶Č£¬²āµĆĪĀ¶Č²īĘ«Š”£»
¢ŚŹµŃ鏱ÓĆ»·ŠĪĶĖæ½Į°č°ō“śĢę»·ŠĪ²£Į§½Į°č°ō£¬É¢Ź§ČČĮ棬²āµĆĪĀ¶Č²īĘ«Š”£»
¢Ū°±Ė®µēĄėŠčŅŖĪüČČ£»
£Ø3£©øł¾ŻĒāŃõ»ÆÄĘ×ćĮæČ·±£ŃĪĖįĶźČ«·“Ó¦£¬·Å³öµÄČČĮæøüĶźČ«£»
£Ø4£©ĪŖ¼õÉŁČČĮæÉ¢Ź§£¬Ó¦Ź¹Š”ÉÕ±æŚÓė“óÉÕ±æŚ³ÖĘ½£¬ĘäÓą²æ·ÖÓĆÅŻÄĖÜĮĻĢīĀś£»
£Ø5£©·“Ó¦·Å³öµÄČČĮæŗĶĖłÓĆĖįŅŌ¼°¼īµÄĮæµÄ¶ąÉŁÓŠ¹Ų£¬²¢øł¾ŻÖŠŗĶČȵÄøÅÄīŗĶŹµÖŹĄ“»Ų“š£®
½ā“š ½ā£ŗ£Ø1£©øł¾ŻĮæČČ¼ĘµÄ¹¹ŌģæÉÖŖøĆ×°ÖƵÄȱɣŅĒĘ÷ŹĒĪĀ¶Č¼Ę£»
¹Ź“š°øĪŖ£ŗĪĀ¶Č¼Ę£»
£Ø2£©¢ŁĪ“¼°Ź±²ā³ö×īøßĪĀ¶Č£¬²āµĆĪĀ¶Č²īĘ«Š”£¬ÓÉQ=cm”÷TæÉÖŖČČĮæĘ«Š”£¬ÖŠŗĶČȵďżÖµĘ«Š”£¬
¹Ź“š°øĪŖ£ŗĘ«Š”£»
¢ŚŹµŃ鏱ÓĆ»·ŠĪĶĖæ½Į°č°ō“śĢę»·ŠĪ²£Į§½Į°č°ō£¬É¢Ź§ČČĮ棬²āµĆĪĀ¶Č²īĘ«Š”£¬ÓÉQ=cm”÷TæÉÖŖČČĮæĘ«Š”£¬ÖŠŗĶČȵďżÖµĘ«Š”£¬
¹Ź“š°øĪŖ£ŗĘ«Š”£»
¢ŪÓĆĻąĶ¬ÅضČŗĶĢå»żµÄ°±Ė®£ØNH3•H2O£©“śĢęNaOHČÜŅŗ£¬°±Ė®µēĄėŠčŅŖĪüČČ£¬ĖłŅŌ²āµĆĪĀ¶Č²īĘ«Š”£¬ÓÉQ=cm”÷TæÉÖŖČČĮæĘ«Š”£¬ÖŠŗĶČȵďżÖµĘ«Š”£¬¹Ź“š°øĪŖ£ŗĘ«Š”£»
£Ø3£©øł¾ŻĒāŃõ»ÆÄĘ×ćĮæČ·±£ŃĪĖįĶźČ«·“Ó¦£¬·Å³öµÄČČĮæøüĶźČ«£¬Ź¹²āµĆµÄŹżÖµøü×¼Č·£»
¹Ź“š°øĪŖ£ŗŹ¹ŃĪĖį³ä·Ö·“Ó¦£»
£Ø4£©ĪŖ¼õÉŁČČĮæÉ¢Ź§£¬Ó¦Ź¹Š”ÉÕ±æŚÓė“óÉÕ±æŚ³ÖĘ½£¬ĘäÓą²æ·ÖÓĆÅŻÄĖÜĮĻĢīĀś£¬ĖłŅŌÅŻÄĖÜĮĻµÄ×÷ÓĆ·ĄÖ¹·“Ó¦·Å³öµÄČČĮæÉ¢Ź§£»¹Ź“š°øĪŖ£ŗ·ĄÖ¹·“Ó¦·Å³öµÄČČĮæÉ¢Ź§£»
£Ø5£©·“Ó¦·Å³öµÄČČĮæŗĶĖłÓĆĖįŅŌ¼°¼īµÄĮæµÄ¶ąÉŁÓŠ¹Ų£¬²¢ČōÓĆ60mL0.50mol/LŃĪĖįÓė50mL0.55mol/LNaOHČÜŅŗ½ųŠŠ·“Ó¦£¬ÓėÉĻŹöŹµŃéĻą±Č£¬Éś³ÉĖ®µÄĮæŌö¶ą£¬Ėł·Å³öµÄČČĮæĘ«øߣ¬µ«ŹĒÖŠŗĶČČµÄ¾łŹĒĒæĖįŗĶĒæ¼ī·“Ӧɜ³É1molĖ®Ź±·Å³öµÄČČ£¬ÓėĖį¼īµÄÓĆĮæĪŽ¹Ų£¬ÖŠŗĶČČŹżÖµĻąµČ£¬
¹Ź“š°ø£ŗ²»ĻąµČ£»ĻąµČ£®
µćĘĄ ±¾Ģā½įŗĻÖŠŗĶ·“Ӧ漲éĮĖĶ¬Ń§ĆĒ¹Ū²ģ·ÖĪöĪŹĢāµÄÄÜĮ¦£¬ŅŌ¼°ĄūÓĆ»Æѧ·½³ĢŹ½¼ĘĖćµÄÄÜĮ¦£¬±Č½Ļ×ŪŗĻ£¬ŅŖČĻÕę·ÖĪö½ā“š£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
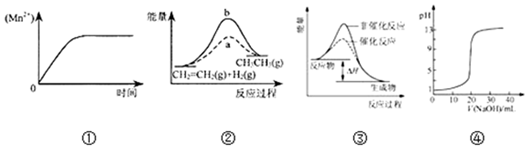
| A£® | Ķ¼¢Ł±ķŹ¾10 mL 0.01 mol•L-1 KMnO4 ĖįŠŌČÜŅŗÓė¹żĮæµÄ0.1 mol•L-1 H2C2O4ČÜŅŗ»ģ ŗĻŹ±£¬n£ØMn2+£© Ėꏱ¼äµÄ±ä»Æ | |
| B£® | Ķ¼¢ŚÖŠa”¢bĒśĻß·Ö±š±ķŹ¾·“Ó¦CH2=CH2 £Øg£©+H2£Øg£©”śCH3CH3£Øg£©£»”÷H£¼0Ź¹ÓĆŗĶĪ“Ź¹ÓĆ“ß»Æ¼ĮŹ±£¬·“Ó¦¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ | |
| C£® | Ķ¼¢Ū±ķŹ¾Ä³·ÅČČ·“Ó¦·Ö±šŌŚÓŠ”¢ĪŽ“߻ƼĮµÄĒéæöĻĀ·“Ó¦¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ | |
| D£® | Ķ¼¢Ü±ķŹ¾0.1000mol•L-1NaOHČÜŅŗµĪ¶Ø20.00mL0.1000mol•L-1CH3COOHČÜŅŗĖłµĆµ½µÄµĪ¶ØĒśĻß |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ·ÖĄą±ź×¼ | Äܵ¼µēµÄĪļÖŹ | µē½āÖŹ | ·Ēµē½āÖŹ |
| ŹōÓŚøĆĄąµÄĪļÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ōö“óŃ¹Ē棬»ÆŃ§Ę½ŗā²»Ņ»¶ØŅĘ¶Æ | |
| B£® | ĶØČėŗ¤Ęų£¬»ÆŃ§Ę½ŗāŅ»¶Ø²»·¢ÉśŅĘ¶Æ | |
| C£® | Ōö¼ÓX»ņYµÄĪļÖŹµÄĮ棬»ÆŃ§Ę½ŗāŅ»¶Ø·¢ÉśŅĘ¶Æ | |
| D£® | ĘäĖüĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬»ÆŃ§Ę½ŗāŅ»¶Ø·¢ÉśŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | c£ØHCO3-£©£¾c£ØH2CO3£© | B£® | c£ØOH-£©=2c£ØH+£© | ||
| C£® | c£ØNa+£©=2c£ØCO32-£© | D£® | c£ØNa+£©£¼c£ØCO32-£©+c£ØHCO3-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
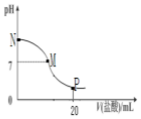 Ļņ10.0mL0.10mol•L-1°±Ė®ÖŠµĪČė0.1mol•L-1ŃĪĖį£¬ČÜŅŗµÄpHÓėĖł¼ÓŃĪĖįµÄĢå»ż¹ŲĻµČēĶ¼ĖłŹ¾£Ø¼ŁÉčĪŽĘųĢåŅĘ³ö£©£¬ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ£Ø””””£©
Ļņ10.0mL0.10mol•L-1°±Ė®ÖŠµĪČė0.1mol•L-1ŃĪĖį£¬ČÜŅŗµÄpHÓėĖł¼ÓŃĪĖįµÄĢå»ż¹ŲĻµČēĶ¼ĖłŹ¾£Ø¼ŁÉčĪŽĘųĢåŅĘ³ö£©£¬ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ£Ø””””£©| A£® | M-N¼äŅ»¶Ø“ęŌŚc£ØCl-£©£¾c£ØNH4+£©£¾c£ØOH-£©£¾c£ØH+£© | |
| B£® | Mµć¶ŌÓ¦µÄŃĪĖįĢå»żĪŖ10.0mL | |
| C£® | pH=7ČÜŅŗÖŠ“ęŌŚc£ØCl-£©=c£ØNH4+£©=c£ØOH-£©=c£ØH+£© | |
| D£® | pµć“¦µÄČÜŅŗÖŠ“ęŌŚ£ŗ2 c£ØNH4+£©+2c£ØNH3•H2O£©=c£ØCl-£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com