
下列关于离子键的说法中正确的是( )
A.离子键一定在活泼金属和活泼非金属元素的原子之间形成
B.形成离子键时离子间的静电作用指的是静电吸引
C.形成离子键时,离子半径越大离子键就越强
D.非金属元素的原子之间也可以形成离子键
科目:高中化学 来源: 题型:
下列晶体中,前者属于原子晶体,后者属于分子晶体的是( )
A.硅晶体、二氧化硅晶体
B.足球烯(C60)、天然气水合物
C.金刚石、冰
D.干冰、碳化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
金属晶体、离子晶体和分子晶体采取密堆积方式的原因是( )
A.构成晶体的微粒均可视为圆球
B.金属键、离子键、分子间作用力均无饱和性和方向性
C.三种晶体的构成微粒相同
D.三种晶体的构成微粒多少及相互作用力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.离子化合物中的阳离子不一定是金属离子
B.阴、阳离子通过静电引力而形成的化学键叫做离子键
C.离子化合物如能溶于水,其水溶液一定可以导电
D.大多数的盐、碱和低价金属氧化物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子排布的原子中最难形成离子键的是( )
A.1s22s22p2 B.1s22s22p5
C.1s22s22p63s2 D.1s22s22p63s1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氮化钠(Na3N)在熔融时能导电,与水作用时有NH3产生。试回答下列问题:
(1)Na3N中存在的离子为____________,Na3N属于________化合物。
(2)比较微粒的半径Na+________N3-(填“<”、“>”或“=”)。
(3)Na3N与水作用时的化学反应方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.该氯原子的相对原子质量为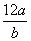
B.m g该氯原子的物质的量为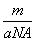 mol
mol
C.该氯原子的摩尔质量是aNA g
D.a g该氯原子所含的电子数为17 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,溶液中含氢氧化钠的质量为m g,该温度下NaOH的溶解度为S。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为________________________________________________________________________。
(2)用c、d来表示该温度下NaOH的溶解度(S)为________________________________________________________________________。
(3)用m、V表示溶液中溶质的物质的量浓度(c)为________________________________________________________________________。
(4)用w、d表示溶液中溶质的物质的量浓度(c)为________________________________________________________________________。
(5)用c、d表示溶液中溶质的质量分数(w)为________________________________________________________________________。
(6)用S表示溶液中溶质的质量分数(w)为________________________________________________________________________。
(7)用S、d表示溶液中溶质的物质的量浓度(c)为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com