
50mL 0.50mol•L﹣1的盐酸与50mL 0.55mol•L﹣1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,完成下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .请指出装置中的另外错误是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热 (填“偏大”“偏小”“无影响”).
(4)实验中改用60mL 0.50 mol•L﹣1的盐酸跟60mL 0.55 mol•L﹣1NaOH溶液进行上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”).
(5)用相同浓度体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50mL 0.50mol•L﹣1NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”“无影响”).

考点:
中和热的测定.
专题:
实验题.
分析:
(1)根据量热计的构造来判断该装置的缺少仪器;根据量热计的构造来判断该装置的不足之处;
(2)中和热测定实验成败的关键是保温工作;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)NH3•H2O是弱电解质,电离吸热;根据中和热的概念和实质来回答.
解答:
解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温、隔热,减少实验过程中的热量损失;为了防止热量散失,小烧杯杯口与大烧杯杯口相平;
故答案为:环形玻璃搅拌棒;小烧杯杯口与大烧杯杯口不相平;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,用60mL 0.50 mol•L﹣1的盐酸跟60mL 0.55 mol•L﹣1NaOH溶液进行上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL 0.50 mol•L﹣1的盐酸跟60mL 0.55 mol•L﹣1NaOH溶液进行上述实验相比,测得中和热数值相等;
故答案为:不相等;相等;
(5)NH3•H2O是弱电解质,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ;反应放出的热量和所用酸以及碱的量的多少有关,用50mL 0.50mol•L﹣1NaOH溶液进行上述实验,生成水的量偏少,所放出的热量偏低,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
故答案为:偏小;相等.
点评:
本题考查学生有关中和热的测定知识,可以根据所学知识进行回答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
为了科学饮食,了解一些与食品相关的化学知识是必要的。
(1 )油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中不应该充入的是________。
)油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中不应该充入的是________。
A.氮气 B.二氧化碳 C.空气 D.氧气
(2)为使以面粉为原料的面包松软可口,通常用碳酸氢钠作发泡剂,因为它________。
①热稳定性差 ②增加甜味
③产生二氧化碳 ④提供钠离子
A.②③ B.①③ C.①④ D.③④
(3)能直接鉴别氯化钠和葡萄糖两种未知浓度溶液的方法是________。
A.观察颜色 B.测量比重 C.加热灼烧 D.分别闻味
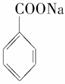
(4)苯甲酸钠是常用的食品防腐剂,其结构简式如图。以下对苯甲酸钠描述错误的是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系 如下图所示。
如下图所示。
下列判断正确的是( )
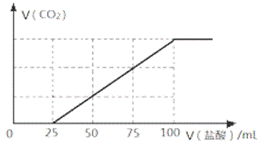
A.原NaOH溶液的浓度为0.1 mol/L
B.通入CO2的体积为448 mL
C.所得溶液的溶质成分的物质 的量之比为n(NaOH):n(Na2CO3) = 1: 3
的量之比为n(NaOH):n(Na2CO3) = 1: 3
D.所得溶液的溶质成分的 物质的量之比为n(NaHCO3):n(Na2CO3) = 2: 1
物质的量之比为n(NaHCO3):n(Na2CO3) = 2: 1
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
|
| A. | ﹣488.3 kJ/mol | B. | +488.3 kJ/mol |
|
| C. | ﹣191 kJ/mol | D. | +191 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
填空:
(1)用电子式表示H2O和MgBr2的形成过程H2O
MgBr2
(2)写出CO2、Na2O2、H2O2的电子式:CO2 Na2O2 HClO
(3)依据事实,写出下列反应的热化学方程式.
①若适量的N2和O2完全反应,如果生成23g NO2需要吸收16.95kJ热量,则表示该反应的热化学方程式为
②已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=﹣25kJ/mol①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=﹣47kJ/mol②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ/mol③
请写出CO还原FeO的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示.下列判断正确的是( )

|
| A. | 原子半径:丙<丁<戊 | B. | 氢氧化物碱性:丙>丁>戊 |
|
| C. | 金属性:甲>丙 | D. | 最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
“铝热反应”的化学方程式为:2Al+Fe2O3 Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | ﹣﹣ |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金.这种推测有一定的道理,理由是: .
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是 ,当观察到 现象时,说明熔融物中含有金属铝,反应的离子方程式为 .
(3)实验室溶解该熔融物,最好选用下列试剂中的 (填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2(g)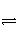
 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com