
下列叙述正确的是( )
|
| A. |
|
|
| B. | 不同元素的原子构成的分子只含极性共价键 |
|
| C. |
|
|
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
考点:
核素;原子核外电子排布;极性键和非极性键.
专题:
原子组成与结构专题.
分析:
A、放出射线不是化学变化研究的范畴
B、不同元素的原子构成的分子可以含非极性键;
C、中子数不同质子数相同是不同的核素;
D、短周期第ⅣA与元素原子最外层四个电子,ⅦA族元素的原子最外层七个电子,结合化学键的形成分析判断;
解答:
解:A、放出射线是原子核内的变化不是化学变化的研究范畴,不是化学变化,故A错误;
B、不同元素的原子构成的分子可以含非极性键,如H2O2,故B错误;
C、 和
和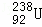 是中子数不同质子数相同的同元素的不同核素,故C错误;
是中子数不同质子数相同的同元素的不同核素,故C错误;
D、短周期第ⅣA与元素原子最外层四个电子,ⅦA族元素的原子最外层七个电子,四个ⅦA族元素的原子和一个第ⅣA与元素原子形成四个共价键,达到最外层的8电子结构,故D正确.
故选D.
点评:
本题考查了核素概念应用,核外电子排布特征的应用,极性键和非极性键的形成,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
只用一种试剂就能把Na2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液区分开来,这种试剂是()
A. AgNO3 B. NaOH C. BaCl2 D. Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)高炉炼铁中起还原作用的物质是CO,该物质与氧化铁发生反应的化学方程式是
(2)FeCl2溶液中加入氢氧化钠溶液,反应的现象是 ,所涉及的化学方程式有:
(3)写出下列反应的离子方程式
硫酸与氢氧化钡:
碳酸氢钠与盐酸:
碳酸氢钠与氢氧化钠: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于晶体说法的正确组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2﹣紧邻
⑥60gSi02中含Si﹣O键的个数为2NA
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
⑨124g P4含有P﹣P键的个数为4NA.

|
| A. | ①②③⑥ | B. | ①②④ | C. | ③⑤⑦ | D. | ③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
|
| A. | X与Y形成化合物是,X显负价,Y显正价 |
|
| B. | 第一电离能可能Y大于X |
|
| C. | 当它们均为非金属时,气态氢化物的稳定性:X大于Y |
|
| D. | 当它们均为非金属时,最高价含氧酸的酸性:X小于Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高.
(1)基态钛原子的核外电子排布式为 .
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于 晶体.
(3)SO42﹣和 S2O82﹣(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是 .
A.SO42﹣中存在σ键和π键且与PO43﹣离子互为等电子体
B.S2O82﹣中存在非极性键且有强氧化性
C.S2O82﹣比SO42﹣稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ,原因是 .
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ,分子的空间构型为 .
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比 .
查看答案和解析>>
科目:高中化学 来源: 题型:
由铜片、锌片和200mL稀H2SO4组成的原电池中,若锌片发生电化学腐蚀,则当铜片上放出3.36L(标态)气体时,硫酸恰好全部作用完.试计算:
(1)产生这些气体消耗了多少克锌
(2)有多少个电子通过了导线
(3)200mL稀H2SO4的物质的量浓度是多少.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com