
分析 4g甲烷的物质的量为:$\frac{4g}{16g/mol}$=0.25mol,将0.25mol CH4(g)和适量氧气混合后通入密闭容器中,点燃使之完全燃烧,待恢复到原来温度时,测得反应前后压强分别为3.03×105Pa和1.01×105Pa,根据阿伏伽德罗定律:$\frac{{P}_{1}}{{P}_{2}}$=$\frac{{N}_{1}}{{N}_{2}}$=$\frac{3.03×1{0}^{5}}{1.01×1{0}^{5}}$=$\frac{3}{1}$及甲烷燃烧方程式CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O可知水的状态为液态;再计算16g甲烷完全燃烧生成二氧化碳和液态水放出热量,结合热化学方程式书写方法写出.
解答 解:4g甲烷的物质的量为:$\frac{4g}{16g/mol}$=0.25mol,将0.25mol CH4(g)和适量氧气混合后通入密闭容器中,点燃使之完全燃烧,待恢复到原来温度时,测得反应前后压强分别为3.03×105Pa和1.01×105Pa,由阿伏加德罗定律的推论可知:$\frac{{P}_{1}}{{P}_{2}}$=$\frac{{N}_{1}}{{N}_{2}}$=$\frac{3.03×1{0}^{5}}{1.01×1{0}^{5}}$=$\frac{3}{1}$,根据甲烷燃烧反应的化学方程式CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O可知,水在该状态下是液体,
同时又测得反应共放热222.5kJ,1mol甲烷(16g)完全燃烧生成二氧化碳和液态水放出热量为:$\frac{222.5kJ}{0.25mol}$=890kJ,
所以甲烷燃烧反应的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol.
点评 本题考查了反应热与焓变的应用,题目难度中等,正确根据阿伏伽德罗定律判断水的状态为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
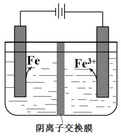
| A. | 阴极主要发生反应:Fe2++2e-═Fe | |
| B. | 向阳极附近滴加KSCN溶液,溶液变红 | |
| C. | 电解一段时间后,阴极附近pH减小 | |
| D. | 电解法制备高纯铁总反应:3Fe2+$\frac{\underline{\;电解\;}}{\;}$Fe+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
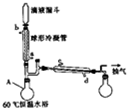 过氧乙酸常用作氧化剂和灭菌剂,实验室合成过氧乙酸并测定其含量的相关步骤如下:
过氧乙酸常用作氧化剂和灭菌剂,实验室合成过氧乙酸并测定其含量的相关步骤如下: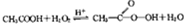
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积比为8:11 | B. | 密度之比为1:1 | ||
| C. | 物质的量之比为11:8 | D. | 原子个数之比为12:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 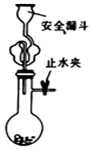 实验室用大理石与盐酸制取CO2 | B. |  制取SO2、检验SO2的漂白性 | ||
| C. | 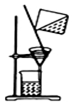 提纯氢氧化铁胶体 | D. | 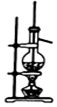 实验室用乙醇和硫酸制已烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲池通入O2的电极反应为O2+4e-+4H+=2H2O | |
| B. | 乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子 | |
| C. | 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com