
| A. | 向稀HNO3中滴加Na2SO3溶液SO32-+2H+═SO2↑+H2O | |
| B. | CuSO4溶液与H2S反应的离子方程式:Cu2++S2-═CuS↓ | |
| C. | 氯气溶于水:Cl2+H2═2H++Cl-+ClO- | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2═4Na++2Cu(OH)2↓+O2↑ |
分析 A.硝酸具有强的氧化性,能够氧化亚硫酸根离子;
B.硫化氢为弱电解质,应保留化学式;
C.次氯酸为弱酸,应保留化学式;
D.二者反应生成氢氧化铜、硫酸钠和氧气.
解答 解:A.向稀HNO3中滴加Na2SO3溶液,离子方程式;2NO3-+2SO32-+2H+═3SO42-+H2O+2NO↑,故A错误;
B.CuSO4溶液与H2S反应的离子方程式:Cu2++H2S═CuS↓+2H+,故B错误;
C.氯气溶于水,离子方程式:Cl2+H2O═H++Cl-+HClO,故C错误;
D.向CuSO4溶液中加入Na2O2,离子方程式:2Na2O2+2Cu2++2H2═4Na++2Cu(OH)2↓+O2↑,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,侧重考查氧化还原反应的离子方程式,明确物质的性质及发生反应的实质是解题关键,注意化学式的拆分,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 125 mL | B. | 275 mL | C. | 325 mL | D. | 450 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
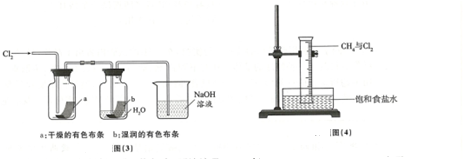
| 实验现象 | 原因 |
| 溶液从初的紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊试液变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粉状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粉状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盛水的烧杯中投入小拇指头大小的钠块,观察现象 | |
| B. | 将一小块钠放在石棉网上加热,观察现象 | |
| C. | 实验后剩余的钠不能放回原瓶 | |
| D. | 用手掰开一块金属钠,观察钠的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)═Ca2++2OH- | B. | KNO3═K++NO3- | C. | NH4Cl═4NH++Cl- | D. | H2SO4═2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+.Na+.NO3-.H+ | B. | NH4+.Fe3+.SO42-.SCN- | ||
| C. | SO42-.Cl-.Cu2+.Mg2+ | D. | Ba2+.K+.SO32-.H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
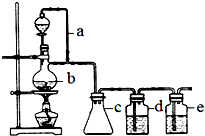 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com