
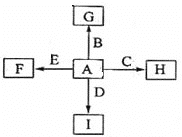
【题目】下图中,A,B,C,D,E是单质,G,H,I,F是B,C,D,E分别和A形成的二元化合物。
已知:①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。
回答问题:
⑴①中反应的化学方程式为______________;
⑵化合物I的电子式为_______,它的空间结构是______;
⑶C与过量NaOH溶液反应的离子方程式为____________,反应后溶于与过量化合物I反应的离子方程式为____________________;
⑷E在I中燃烧观察到的现象是_____________________。
⑸1.6gG溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需的铜粉的质量_____________;
【答案】 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3 ![]() 直线形 2Al+2OH-+2H2O=2AlO2-+3H2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 剧烈燃烧,大量白烟,瓶壁附着有黑色物质 2Fe3++Cu=2Fe2++Cu2+ n(Fe2O3)=0.01mol,依据离子方程式得:n(Cu)=0.01mol,m(Cu)=0.64g。
直线形 2Al+2OH-+2H2O=2AlO2-+3H2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 剧烈燃烧,大量白烟,瓶壁附着有黑色物质 2Fe3++Cu=2Fe2++Cu2+ n(Fe2O3)=0.01mol,依据离子方程式得:n(Cu)=0.01mol,m(Cu)=0.64g。
【解析】根据反应的实验现象、应用以及有关物质的性质、元素含量,结合转化关系图分析解答。
A,B,C,D,E是单质,G,H,I,F是B,C,D,E分别和A形成的二元化合物。已知:①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接,所以C是铝,B是铁,H是氧化铝,因此A是氧气。②I是一种常见的温室气体,则I是CO2,它和E可以发生反应:2E+I
B+H能放出大量的热,该反应曾应用于铁轨的焊接,所以C是铝,B是铁,H是氧化铝,因此A是氧气。②I是一种常见的温室气体,则I是CO2,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%,这说明E是镁,F是氧化镁,D是C,MgO中Mg的含量恰好是60%。根据转化关系图可知G是氧化铁。
2F+D,F中E元素的质量分数为60%,这说明E是镁,F是氧化镁,D是C,MgO中Mg的含量恰好是60%。根据转化关系图可知G是氧化铁。
⑴根据以上分析可知①中反应的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3;⑵化合物CO2的电子式为
2Fe+Al2O3;⑵化合物CO2的电子式为![]() ,它的空间结构是直线形;⑶铝与过量NaOH溶液反应的离子方程式为Al+2OH-+2H2O=2AlO2-+3H2↑,偏铝酸钠与足量CO2反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;⑷镁在CO2中燃烧观察到的现象是剧烈燃烧,大量白烟,瓶壁附着有黑色物质;⑸1.6g氧化铁的物质的量是 n(Fe2O3)=0.01mol,溶于盐酸,得到的溶液中铁离子的物质的量是0.02mol,与铜粉完全反应2Fe3++Cu=2Fe2++Cu2+,依据离子方程式得:n(Cu)=0.01mol,所以m(Cu)=0.01mol×64g/mol=0.64g。
,它的空间结构是直线形;⑶铝与过量NaOH溶液反应的离子方程式为Al+2OH-+2H2O=2AlO2-+3H2↑,偏铝酸钠与足量CO2反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;⑷镁在CO2中燃烧观察到的现象是剧烈燃烧,大量白烟,瓶壁附着有黑色物质;⑸1.6g氧化铁的物质的量是 n(Fe2O3)=0.01mol,溶于盐酸,得到的溶液中铁离子的物质的量是0.02mol,与铜粉完全反应2Fe3++Cu=2Fe2++Cu2+,依据离子方程式得:n(Cu)=0.01mol,所以m(Cu)=0.01mol×64g/mol=0.64g。


科目:高中化学 来源: 题型:
【题目】“一滴香”是有毒物质,被人食用后会损伤肝脏还能致癌。其分子结构如图所示,下列说法正确的是
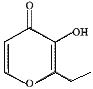
A.该有机物的分子式为C7H7O3
B.该有机物能发生取代、加成和氧化反应
C.1mol该有机物最多能与2mol H2发生加成反应
D.该有机物的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】游泳池的水变绿主要是因为细菌及藻类的急剧繁殖导致的。
(1)含氯物质可以作为游泳池的消毒剂。一般水质正常的游泳池消毒后水中的余氯应保持在0.3~0.5mg/L,pH保持在7.4~7.6,这个环境下细菌和藻类都不易生长和繁殖。
①露天游泳池水由于连续下雨和高温(28~30℃)会导致藻类大量繁殖,其原因是_____________。
②消毒剂的错误使用也会导致藻类大量繁殖,游泳池水变绿。若水中的余氯以次氯酸形式存在,再加入H2O2进行消毒也会导致池水变绿,写出次氯酸与H2O2发生反应生成盐酸的化学方程式_________________。
(2)处理池水变绿的方法分为五步。
①灭藻原理是铜离子可以使叶绿体中毒无法光合作用而死亡;CuSO4溶液也能够杀菌,其原理是_________。加入CuSO4溶液后需要打开水循环系统,其作用是_____________。
②含氯消毒剂杀菌消毒主要体现出的化学性质是_____________。
③选用Na2CO3调节pH至7.5,用化学用语和文字解释其原因_____________。
④聚合氯化铝可将悬浮物和被杀灭的细小藻类沉淀到池底,第二天将池底沉淀移出。稀释聚合氯化铝会产生胶体,其离子反应方程式是_____________;当温度大于80℃时,水体中铝离子的总浓度会降低,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向100 mL 0.1 mol/L NH4Cl溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A. | 100 mL 0.1 mol/L盐酸 | 溶液中2c(NH4+)=" " c(Cl-) |
B. | 0.01 mol Na2O2固体 | 反应完全后,溶液pH增大,c(Na+) = 2c(Cl-) |
C. | 100 mL H2O | 由水电离出的c(H+)c(OH-)不变 |
D. | 100 mL 0.1 mol/L NH3H2O | 溶液中 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 橡胶是重要的工业原料,生胶的弹性好但强度较差,将其硫化后,强度增大则弹性减弱,且硫化程度越高,强度越大,弹性越差。在以下橡胶制品中,你认为硫化程度最高的是( )
A.气球 B.医用乳胶手套 C.汽车外胎 D.橡皮筋
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.某ⅡA族元素的原子序数为a,则原子序数为a+1的元素一定是ⅢA族元素
B.除短周期外,其他周期均有32种元素
C.原子最外层只有2个电子的元素可能是金属元素也可能是非金属元素
D.碱金属元素是指ⅠA族的所有元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com